
科目: 来源:2008届宁夏省中卫一中高三化学第二学期第二次模拟理综化学部分 题型:058
在如图所示的装置中,由A处通入气体,试剂瓶中的现象为溶液先变浑浊,后又变澄清.
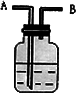
(1)若试剂瓶中的溶液为碱,则通入的气体为________或________.
(2)若试剂瓶中的溶液是显碱性的盐溶液,则通入的气体为________.离子方程式为_______________.
(3)若反应结束后,试剂瓶中的溶液中加入葡萄糖溶液,再水浴加热,生成银镜,则原试剂瓶中的溶液为________,通入的气体为________.
(4)在试剂瓶中加入BaCl2溶液,在A处先通入一种气体,无沉淀产生;若继续通入另一种气体,则有白色沉淀产生,且B处有气体放出,放出的气体遇到空气马上变为红棕色,则气体A为________生成的沉淀为________.
查看答案和解析>>
科目: 来源:2008届海南省农垦中学高三第一次月考、化学试题 题型:058
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验.
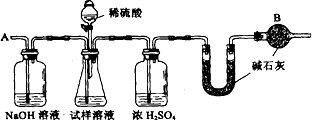
主要实验步骤如下:①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明________
(2)装置中干燥管B的作用是_________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)
(4)步骤⑤的目的是_________________
(5)步骤⑦的目的是_________________
(6)该试样中纯碱的质量分数的计算式为_________
(7)还可以用其他实验方法测定试样中纯碱的质量分数.请简述一种不同的实验法.
查看答案和解析>>
科目: 来源:2008-2009学年度泰安英雄山中学高三年级测试、化学试卷 题型:058
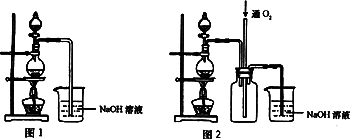
实验室常用的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是________.检查C装置气密性是否良好的操作方法是________.
(2)气体的性质是气体收集方法选择的主要依据.下列性质与收集方法无关的是________(填序号,下同);
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________.
①CO2 ②NO ③Cl2 ④H2
查看答案和解析>>
科目: 来源:2008-2009学年度泰安市宁阳一中第一学期高三期中考试、化学试卷 题型:058
硫酸铜是一种应用极其广泛的化工原料,可通过多种途径制取硫酸铜晶体.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如下图1所示).
请回答相关问题:
(1)图1分液漏斗中装的液体是________;
(2)本实验中若硝酸过量,造成的结果是________;
(3)图2是图1的改进装置,其优点是①________,②________;
(4)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:将铜粉在某仪器中反复灼烧,使铜粉与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向混合物中加入Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,得硫酸铜晶体,滤渣循环使用[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4].
①方案1中用于灼烧铜粉的仪器名称是________;
②方案2中甲物质可以是________(填字母序号);
a.CuO
b.CuCO3
c.CaCO3
d.NaOH
③方案2中发生反应的总化学方程式为(注明反应条件)________.
查看答案和解析>>
科目: 来源:2008-2009学年度上海交通大学附中第一学期高三摸底考试、化学试卷 题型:058
已知甲酸经浓硫酸加热脱水可制得CO,以下试剂和仪器(酒精灯未画出,仪器可重复使用)用于测定当CO气流通过Fe2O3粉末后,发生反应的CO在CO总量中所占的百分比.
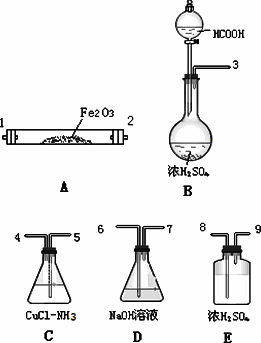
(1)氯化亚铜和氨水溶液吸收CO,实验装置合理的连接顺序自左至右为(填装置接口编号,空格不一定填满)
( )( )( )( )( )( )( )( )( )( )( )( )
(2)装置C和D的顺序不能颠倒,原因是________.
(3)装置B的反应中,浓硫酸是________.
a.吸水剂
b.脱水剂
c.氧化剂
(4)设装置C、D的增重为Δm(C)、Δm(D),发生反应的CO在CO总量中所占的质量分数(CO%)可表示为:CO%=________
如装置D、E的顺序颠倒,将使实验结果CO%________.(填增大、减小或不变)
(5)已知草酸(H2C2O4)有下列反应:
H2C2O4(固)![]() CO+CO2+H2O
CO+CO2+H2O
用草酸热分解代替装置B进行上述实验,下列判断正确的是________.
a.不可行
b.增加CO2吸收装置也可行
c.不必增加任何装置也可行
查看答案和解析>>
科目: 来源:2008-2009学年度山东省莱阳一中高三第一学期学段检测、化学试卷 题型:058
科学研究往往建立在合理的假设之上.下面是两个对照实验:
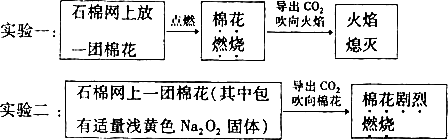
(1)提出问题,实验一中的CO2能灭火,而实验二中的CO2为何能“点火”?
(2)对实验二提出假设与猜想:猜想1:CO2被Na2O2吸收.可能生成Na2CO3;猜想2:棉花被点燃,说明上述反应________;猜想3:棉花燃烧剧烈,说明上述反应________.
(3)设计并进行实验,观察、解释和总结.
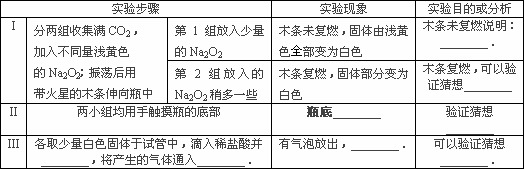
(4)类比推理与实验解释:Na2O2与H2O反应后应该有NaOH和O2生成.若用脱脂棉包裹Na2O2然后加水也应该有燃烧现象.下面是一同学的实验记录:向小烧杯(底部垫砂)中包有Na2O2的脱脂棉上滴水,发现有气泡产生,杯底发热,棉花没有燃烧,分析可能原因________;向杯中的溶液滴入酚酞,溶液变红色,振荡后红色消失,其原因可能是________.
查看答案和解析>>
科目: 来源:2008-2009学年度山东省莱阳一中高三第一学期学段检测、化学试卷 题型:058
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案.
[方案一]气体分析法.
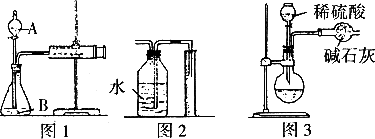
(1)甲同学用图1所示装置,把xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.实验开始时检查该装置气密性的方法是________.
(2)乙同学用图2代替图1中的收集装置,则所测CO2气体的体积________(填“偏大”、“偏小”、“不变”),你的改进方案是________.
(3)丙同学用图3装置测定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你填写其中的三点缺陷:
Ⅰ__________________;
Ⅱ__________________;
Ⅲ__________________.
[方案二]沉淀分析法(如图所示).
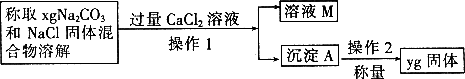
(4)操作1的名称是________;操作2的名称是________.在进行操作1之前,应判断是否沉淀完全,判断的方法是________.
(5)根据沉淀分析法,该固体混合物中Na2CO3质量分数的计算式为________.
查看答案和解析>>
科目: 来源:2008-2009学年度山东省莱阳一中高三第一学期学段检测、化学试卷 题型:058
碘缺乏症(IDD)给患者的智力与健康造成明显的伤害,对婴幼儿的危害尤其严重.为控制该病的发生,最有效的方法是食用加碘盐.我国政府规定在食盐中必须添加碘酸钾(KIO3).
某同学查阅资料后,确定采用下列反应检验食盐中是否含有碘元素.
KIO3+5KI+3H2SO4(稀)=3I2+3H2O+3K2SO4
(1)上述氧化还原反应中,做氧化剂的物质是________;在实际检验过程中,为使实验现象明显,常加入一种试剂,该试剂是________.
(2)结合上述反应分析,在食盐中添加KIO3而不添加KI的原因是________(用化学反应式表示,不必配平).
(3)某学生欲用CCl4从反应液中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中.
(B)把20 mL反应液和5 mL CCl4加入分液漏斗中,并盖好玻璃塞.
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液.
(D)倒置漏斗用力振荡,并不吋旋开活塞放气.最后关闭活塞,把分液漏斗放正.
(E)旋开活塞,用烧杯接收溶液.
(F)将上层水溶液从分液漏斗上口倒出.
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔.
(H)静置,分层.
上述正确操作步骤的顺序是(用上述各操作的编号字母填写)
□→□→□→□→□→□→□→□;
上述E步骤的操作应注意________.
查看答案和解析>>
科目: 来源:2008-2009学年度济宁市育才中学高三阶段性测试、化学试卷 题型:058
硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气请用下图所示装置测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.实验测得数据和有关结果如下:①准确称得无水硫酸铜4.8 g;②测出量筒中水的体积,折算成标况下气体的体积为224 ml;③干燥管在实验后质量增加2.56 g;④实验结束时装置B中的NaHSO3溶液变为Na2SO4溶液(不含其他溶质).
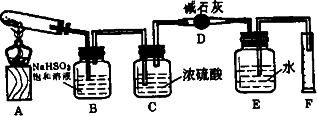
试回答:
(1)装置B的作用是:________,写出B中的反应方程式:________
(2)装置C的作用是:_________
(3)装置E和F的作用是________
(4)实验数据测出后,首先应计算出的物质是________,有________mol,据此计算出硫酸铜分解产生的SO2为________mol,SO3为________mol
(5)硫酸铜受热分解反应的化学方程式为________
查看答案和解析>>
科目: 来源:2008-2009学年度济宁市育才中学第一学期高三期中考试、化学试卷 题型:058
有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
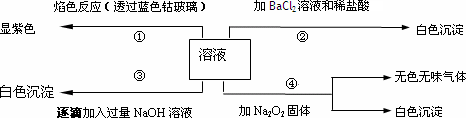
第③个实验中,生成白色沉淀的量与加入NaOH的量有下图所示的相互关系.据此可知:
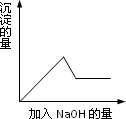
(1)在原溶液中一定不存在的离子有________,
(2)为满足该溶液中一定存在的离子的要求,一般可溶解两种常见物质为(写化学式)________和________.
(3)写出第③个实验中发生反应的离子方程式
_______________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com