
科目: 来源:黑龙江省哈师大附中2010届高三上学期第一次月考化学试题 题型:058
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转化为MnO2和KMnO4;滤去MnO2(此物质不循环使用)沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4.请回答:
(1)软锰矿制备K2MnO4的化学方程式是________.
(2)K2MnO4制备KMnO4的离子方程式是________.
(3)若用8.7 g软锰矿(含MnO230%)进行上述实验,计算KMnO4的理论产量n(KMnO4)=________.
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的化学方程式是________.
(5)上述制得的KMnO4产品63.2 g,恰好与0.5 mol Na2C2O4反应完全,计算该KMnO4的纯度为________.
查看答案和解析>>
科目: 来源:河南省济源一中2010届高三9月月考化学试题 题型:058
用沉淀法测定NaHCO3和K2CO3混合物的组成.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应.实验记录见下表:

回答下列问题:
(1)写出少量NaHCO3和过量Ba(OH)2溶液反应的离子方程式:________
(2)第2次实验中产生沉淀质量是________g,
(3)样品中NaHCO3和K2CO3的物质的量之比是________;
(4)原Ba(OH)2溶液的浓度为________mol/L
(5)室温下取第3组实验所得溶液体积的![]() ,加水配成500 mL溶液,则稀释以后溶液的pH为________
,加水配成500 mL溶液,则稀释以后溶液的pH为________
查看答案和解析>>
科目: 来源:河南省济源一中2010届高三9月月考化学试题 题型:058
一种澄清透明的溶液中可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH4+、Cl-、I-、NO3-、HCO3-、SO32-、SO42-现做以下实验:
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色
(2)取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀
(3)将(2)的沉淀过滤.由滤液中加入硝酸银溶液,产生白色沉淀
(4)另取溶液,逐滴加入氢氧化钠溶液至过量,只观察到有红棕色沉淀生成,且沉淀量不减少.由此可以推断:
溶液中肯定存在的离子有:________.
溶液中肯定不存在的离子有:________.
溶液中还不能确定是否存在的离子有:________.
查看答案和解析>>
科目: 来源:广东阳春一中2010届高三第一次月考化学试卷 题型:058
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验.

主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明________
(2)装置中干燥管B的作用是________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果________(填高、偏低或不变)
(4)步骤⑤的目的是________
(5)步骤⑦的目的是________
(6)该试样中纯碱的质量分数的计算式为________
查看答案和解析>>
科目: 来源:广东阳春一中2010届高三第一次月考化学试卷 题型:058
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2中的几种均匀混合而成,取样品进行如下实验(部分产物略去):
(1)Z的分子式是________.
(2)在实验②中观察到的现象是“沉淀部分溶解”.为进一步确定X的组成,向实验②后的溶液中滴加过量的氨水,有沉淀生成,写出生成沉淀的离子反应方程式为________,则沉淀X含有的物质的化学式为________、________、________.

(3)取滤液Y,测得其pH>7,向其中滴入硫酸钠溶液,未观察到任何现象,则滤液Y中一定含有的含氧酸根离子是(用离子符号表示)________、________,由此推测“将过量的气体Z通入滤液Y中”的实验现象是________.
查看答案和解析>>
科目: 来源:广东阳春一中2010届高三第一次月考化学试卷 题型:058
检查装置气密性是化学实验中的重要操作之一.试按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是________(填序号,下同).
A、容量瓶
B、洗气瓶
C、分液漏斗
D、酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致后果的叙述中,正确的是________.
A、收集不到气体
B、造成环境污染
C、观察到的实验现象有误
D、引发爆炸事故
(3)检查下图所示简易气体发生装置的气密性操作是:________

(4)关闭活塞,随后反应停止,它的原理是:________
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:058
某同学用如下图Ⅰ所示的装置来探究SO2的性质及有关实验.

(1)实验前应先检验装置的气密性,方法是________
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式________
(3)分别将SO2气体通入下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是________,继续通入过量的SO2气体,现象是________.
②SO2通入紫红色KMnO4溶液,现象是________,写出反应的离子方程式________.
③SO2慢慢通入(可以1个气泡1个气泡地通入)澄清石灰水中,现象________.
④SO2通入少量的澄清石灰水中,没有明显现象,产生此现象的原因是________.
(4)若该同学制取的SO2气体中混有CO2气体,请你设计实验证明混合气体中既有SO2气体,又有CO2气体.
可以选择图Ⅱ洗气装置设计实验.洗气装置里的溶液是:A浓硫酸、B氢氧化钠溶液、C硫酸铜溶液、D品红溶液、E澄清石灰水、F高锰酸钾溶液、G碳酸氢钠溶液.
上述装置的连接顺序是(用字母表示,所给装置可以重复使用,有些装置也可以不用)________.
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:058
某研究性学习小组设计如图所示装置,用浓硝酸、铜片、水等三种试剂进行实验,探究浓、稀硝酸的强氧化性并观察它们的还原产物.

填写下列空白.
[实验探究]
(1)探究浓硝酸的强氧化性.
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管放入约2 mL浓硝酸,用排水法收集产生的气体.
①实验中观察到能证明浓硝酸具有强氧化性的现象是________;
②具支试管中发生反应的化学方程式为:________
(2)探究稀硝酸的强氧化性.
①上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是________;
②能证明稀硝酸与铜反应的还原产物为NO的实验现象是________(填标号).
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
[实验反思]
(1)某同学提出,实验过程中若操作不慎,易出现倒吸现象.对该实验装置进行改进的方案是:可在b与c之间连接________.
(2)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验顺序的合理性是________.
[问题讨论]
在用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色.针对此现象,同学们进行讨论,提出两种意见:
①认为两溶液所显颜色不同的原因,是因为Cu2+浓度的差异引起的.
②认为前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的.
你认为上述意见________(填“①”或“②”)合理.(注:若选填①,下题中只答Ⅰ;若选填②,下题中只答Ⅱ)
Ⅰ.如果你认为①合理,理由是________.
Ⅱ.如果你认为②合理,请设计一个简单的实验进行验证:________
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:058
(1)浓硫酸和木炭粉在加热条件下发生反应的化学方程式为:________.
(2)如图装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,请写出还可以用什么简单的方法证明该装置不漏气:________.

(3)如果用图中的装置检验浓硫酸和木炭粉反应的全部产物,写出以下标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂为________,作用是________.
B中加入的试剂为________,作用是________.
C中加入的试剂为________,作用是除尽________气体.
D中加入的试剂为________,作用是________.
(4)实验时,C中应观察到的现象是:________.
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:058
某同学查资料得知.α-AgI是一种固体导体,导电率很高.固体导体导电的原理是构成离子晶体的某一离子在晶体孔隙中自由移动.他为了研究α-AgI究竟是Ag+导电还是I-导电,设计一个如下图所示(用铅蓄电池做电源)的电化学实验.
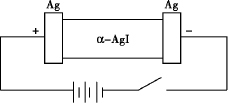
已知铅蓄电池总反应:![]()
(1)铅蓄电池的正极电极方程式:(已知硫酸铅为难溶物)
_____________________________________
(2)若Ag+导电,α-AgI本身质量将________.(填“不变”“变大”或“变小”)
电解池的阳极电极方程式:________
若I-导电,阳极附近的α-AgI晶体密度将会________.(填“不变”“变大”或“变小”)
(3)若通电一段时间后铅蓄电池中消耗了1 mol H2SO4,则电解池的阴极增重________g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com