
科目: 来源:上海市虹口区2010届高三第二次模拟考试化学试题 题型:058
利用Y型管与其它仪器组合可以进行许多实验(固定装置略).分析并回答下列问题:
(1)实验目的:验证SO2有氧化性将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________;硫化亚铁处加水的目的是________.
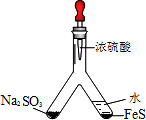
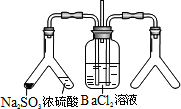
(2)实验目的:探究SO2与BaCl2反应产生沉淀的条件
二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是________、________(必要时可以加热),该沉淀的化学式为________.
(3)实验目的:探究电石气中的成分
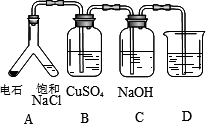
①装置A中的化学反应方程式为:________.
②B装置中出现黑色沉淀,可判断电石气中含有________;C装置的作用为________.
③为验证电石气的主要成分,D中盛放________.
(4)实验目的:锌铁合金中铁含量的测定

①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是________.
②若称得锌铁合金的质量为0.117 g,量气管中初读数为1.00 mL,末读数为45.80 mL,则合金中铁的含量为________%(保留2位小数,已折算标况).
查看答案和解析>>
科目: 来源:山东省莘县实验高中2010届高三上学期模拟考试化学试题 题型:058
硫酸亚铁晶体(
FeSO4·7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下: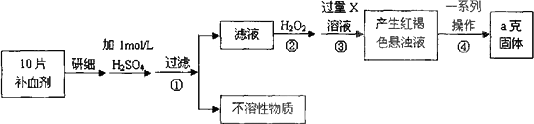
请回答下列问题:
(
1)步骤②加入过量H2O2的目的:________(
2)步骤③中反应的离子方程式:________(
3)步骤④中一系列处理的操作步骤:过滤、________、灼烧、________、称量.(
4)若实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示).(
5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.(5Fe2
++MnO4-+8H+=5Fe3++Mn2++4H2O)①实验前,首先要精确配制一定物质的量浓度的
KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需__________②上述实验中的
KMnO4溶液需要酸化,用于酸化的酸是________.a.
稀硝酸b.
稀硫酸c.
稀盐酸d.
浓硝酸③某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)

查看答案和解析>>
科目: 来源:贵州省云峰中学2010届高三下学期3月月考化学试题 题型:058
下面是某化学学习小组的同学进行探究草酸晶体受热分解的产物和利用其产物进行实验的过程,请你参与并协助他们完成相关学习任务.
[查阅资料]该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:

[提出猜想](1)草酸分解产物中有水;
(2)草酸分解产物中的气体可能是CO、CO2或它们的混合物.
[设计方案]:化学学习小组的同学经过讨论,设计了如下图所示的装置进行“猜想”的实验探究和进行某赤铁矿石经处理后样品的测定.已知:A中装有草酸晶体,B中装有碱石灰,C中装有m g样品(杂质只含有CuO、FeO),D中盛装足量的澄清石灰水.

[讨论与交流]
(1)上图A是用来加热草酸晶体并验证“猜想(1)”的.小华认为该装置错误,正确应是试管口略向下倾斜的,你的判断和理由是______________.
(2)请你设计完成“证明分解产物中有CO2”的实验方案[用简要的实验装置图在方框内表示,要体现所使用仪器和试剂].
(3)证明分解产物中有CO的现象是_______________.
(4)样品在充分还原后,得金属混合物10 g,D中得到20.0 g沉淀.则:
①样品的质量是多少g?;
②通过上述方法制得的金属混合物放置一段时间后,发现表面生锈(铜未生锈),取b g加入1 L 1 mol·L-1的H2SO4溶液中(整个反应过程中无气体产生),完全溶解,最终溶液中c(Fe3+)=0.1 mol·L-1、c(Cu2+)=0.05 mol·L-1,则b的范围是多少(假设反应后溶液的体积为1 L).(写出计算过程)
(5)E装置的作用是_________________.
查看答案和解析>>
科目: 来源:安徽省淮北市第一中学2010届高三上学期第三次月考化学试题 题型:058
某校化学研究性学习小组的同学在学习了氨的性质持讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式________;
(2)在实验室中,还可以用浓氨水与________(填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气.
你认为他能否达到目的?________(填“能”或“否”),理由是____________.
(二)实验探究
该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
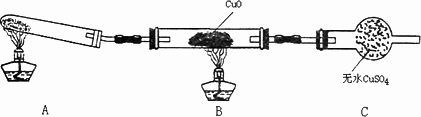
该装置在设计上有一定缺陷,可以采取的的改进措施是__________________.
利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的N2.
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+→Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O.________;
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是
他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变为红色粉末A.冷却后称量,A的质量为72 g.据此可推得,A的化学式为________.由此,得到的结论是________.
(四)兴趣探究
将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑.再在酒精灯上将该铜丝加热至红热状态.如下图所示,趁热插入到试管里的氯化铵晶体中,在试管中出现白烟.冷却后取出铜丝变成亮红色.
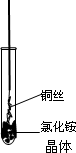
(1)试管中出现白烟的有关化学方程式为____________.
(2)铜丝灼热后在氯化铵中由黑变红的有关化学方程式___________.
查看答案和解析>>
科目: 来源:四川省广元中学2010届高三第四次月考、化学试卷 题型:058
我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高,并能进行连续生产,从而享誉中内外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3Na2![]() CO3+CO2+H2O
CO3+CO2+H2O
某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如下一套实验装置

实验室可选药品有浓氨水、纯碱、大理石、稀盐酸、稀硫酸、熟石灰、氯化铵、氯化钠
(1)选用最合适的试剂的名称D________
(2)本实验具体操作过程中,应先通________气体,再通________气体;
(3)指出该装置的三处错误________ ________ ________
(4)在改进装置后,该同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5 g,实验最后得到无水碳酸钠26 g,则其产率为________;该同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是________
(5)在“侯氏制碱法”的工业生产中,原料的利用率高,大大降低了成本.请问本实验中哪些物质可重复利用?________
查看答案和解析>>
科目: 来源:湖南省浏阳一中2010届高三第四次月考、化学试卷 题型:058
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH![]() 、Ba2
、Ba2
①在A或D中滴入C,均有沉淀生成
②D和B混合加热生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)A、B、C、D、的化学式分别为:A________ B________ C________ D________
(2)写出实验②中有关反应的离子方程式________,________.
查看答案和解析>>
科目: 来源:湖南省衡阳八中2010届高三第四次月考、化学试卷 题型:058
二氯化硫
(SCl2)熔点-78℃,沸点59℃,密度1.638 g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置.试回答下列问题: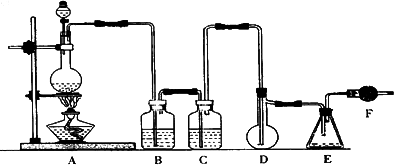
(1)装置A中发生反应的化学方程式为________.
(2)装置B应盛放的药品是________,C中是________.
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是________.
(4)实验时,D装置需加热至50-59℃.最好采用________方式加热.
(5)F装置中干燥管内所盛物质是________,作用是________.
查看答案和解析>>
科目: 来源:河南省沁阳一中2010届高三第四次月考、化学试卷 题型:058
图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状.

(1)在图甲中,试管M中的液体应选用________.
(2)在图示的虚线框中应连入的最合适的装置是________(填代号)
(3)上述制氢气的方法与将铝片直接加入试管中相比,其优点有________.
(4)实验过程中,在试管M中可观察到的现象是________.
(5)实验时,细铜丝“Ⅱ”的操作方法是________.
(6)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体为________;发生反应的离子方程式为________.
查看答案和解析>>
科目: 来源:甘肃省兰州五十五中2009-2010学年度第一学期期末试卷高三化学 题型:058
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)这些装置的连接顺序(按气体左右的方向)是________→________→________→________→________→________→________→________.(填各接口的编号).
(2)实验时甲仪器的作用与原理是________________.
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时I处滴入浓硫酸与II处加热催化剂的先后顺序是________.
(4)Ⅳ处观察到的现象是____________.
(5)在I处用火火加热烧瓶时,SO2的转化率会________(填“增大”“不变”或“减小”).
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得III处增重mg,则本实验中SO2的转化率为________________.
查看答案和解析>>
科目: 来源:2007年普通高等学校招生全国统一考试、化学(天津卷) 题型:058
二氯化二硫(S2C12)在工业上用于橡胶的硫化.为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2C12粗品.
②有关物质的部分性质如下表:
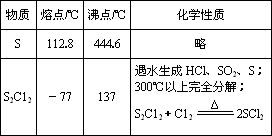
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见________________________________.
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:_____________________________;
E中反应的化学方程式:________________________________.
(3)C、D中的试剂分别是________________、________.
(4)仪器A、B的名称分别是________、________,F的作用是________.
(5)如果在加热E时温度过高,对实验结果的影响是________________,在F中可能出现的现象是________.
(6)S2C12粗品中可能混有的杂质是(填写两种)_________、_________,为了提高S2C12的纯度,关键的操作是控制好温度和________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com