
科目: 来源:2011年高考化学总复习30分钟限时训练:专题18 氯及其化合物 题型:058
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列,从海水中提取食盐和溴的过程如下:
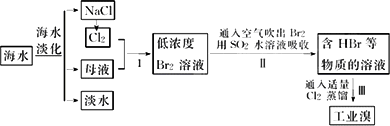
(1)请列举海水淡化的两种方法:________、________.
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为________.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________.
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料;Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,绘制了如下装置简图:
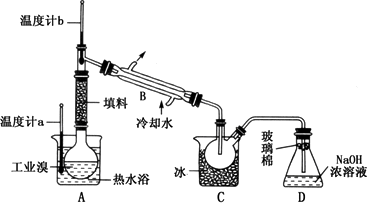
请你参与分析讨论:
①图中仪器B的名称:________.
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是________.
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________.
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题16 铁铜及其化合物 题型:058
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:

请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号).
a.KMnO4
b.(NH4)2S
c.H2O2
d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作.除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________.
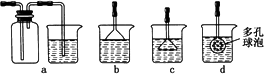
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式).若实验过程中有氨气逸出,应选用下列________装置回收(填代号).
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________,直到________.用KMnO4标准溶液滴定时应选用________(填“酸式”或“碱式”)滴定管.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题16 铁铜及其化合物 题型:058
由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法.甲同学:在如图所示装置中,用铁屑、6 mol·L-1的硫酸、NaOH溶液制备.
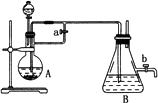
(1)实验开始时应先将活塞a________,活塞b________(填“打开”或“关闭”).
(2)为了制得Fe(OH)2沉淀,在装置A和B中加入试剂后的实验步骤为________.
(3)这样生成的Fe(OH)2沉淀能较长时间不变色,其理由是________.
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为________.
(5)下列各图示中________能较长时间看到Fe(OH)2白色沉淀.
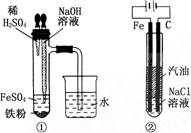
乙同学:只是将甲同学所用药品中的铁屑改为FeS固体,其余都与甲相同.
(6)对乙同学的这一改变请你作出评价:________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题16 铁铜及其化合物 题型:058
某同学在一只烧杯里装有a g纯铁粉,加入200 mL 6 mol/L硝酸恰好完全溶解铁粉(假设还原产物只有NO).请完成对产物中铁元素价态的探究:
(1)提出合理假设:
假设1:产物只有+2价铁;
假设2:________;
假设3:________.
(2)设计实验:分别取反应后溶液装入两支试管甲、乙,在甲试管中滴加酸性高锰酸钾溶液;在乙试管中滴加KSCN溶液,观察现象.
推测实验现象与结论:①若现象为:________,
则假设1正确;②若现象为:________,
则假设2正确;③若现象为:________,
则假设3正确.
(3)a值范围为________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题15 铝及化合物 题型:058
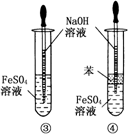
某研究性小组借助A~D的仪器装置完成有关实验.
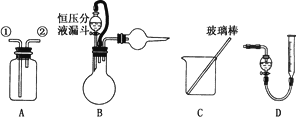
[实验一]收集NO气体
(1)用装置A收集NO气体,正确的操作是________(填序号)
a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
c.从②口进气,用排水法集气
d.从②口进气,用排气法集气
[实验二]为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH![]() Na2ZnO2+H2↑,据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g.用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验.
Na2ZnO2+H2↑,据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g.用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验.
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标.
(2)选用B和________(填仪器标号)两个装置进行实验.
(3)测得充分反应后生成氢气的体积为V L(标准状况),则ω(Zn)=________.
(4)计算镀层厚度,还需要检索的一个物理量是________.
(5)若将装置B的恒压分液漏斗改为普通分泌漏斗,测量结果将________(填“偏大”“偏小”或“无影响”).
方案乙:通过称量试样与碱反应前后的质量实现探究目标.选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g.
(6)ω(Zn)=________.
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标.实验同样使用仪器C.
(7)从实验误差角度分析,方案丙________(填“优于”“劣于”或“等同于”)方案乙.
查看答案和解析>>
科目: 来源:2011年全国普通高等学校招生统一考试化学试题上海卷 题型:058
CuSO4·5H2O是铜的重要化合物,有着广泛的应用.以下是CuSO4·5H2O的实验室制备流程图.
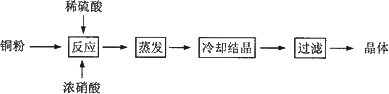
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:________、________.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是________,除去这种杂质的实验操作称为________.
(3)已知:CuSO4+2NaOH![]() Cu(OH)2↓+Na2SO4
Cu(OH)2↓+Na2SO4
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O________g.
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用________.
在滴定中,准确读数应该是滴定管上蓝线________所对应的刻度.
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①________②加水溶解 ③加氯化钡溶液,沉淀 ④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是________
(6)如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为________.
查看答案和解析>>
科目: 来源:2011年全国普通高等学校招生统一考试化学试题上海卷 题型:058
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
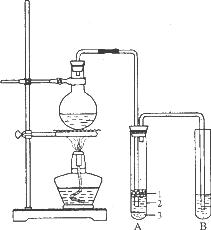
(1)圆底烧瓶中加入的反应物是溴化钠、________和1∶1的硫酸.配制体积比1∶1的硫酸所用的定量仪器为________(选填编号).
a.天平
b.量筒
c.容量瓶
d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式________.
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________.
试管A中的物质分为三层(如图所示),产物在第________层.
(4)试管A中除了产物和水之外,还可能存在________、________(写出化学式).
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是________(选填编号).
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是________.
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:________.
查看答案和解析>>
科目: 来源:山东省莱州市第一中学2011届高三第二次质量检测化学试题 题型:058
现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.(由实验装置引起的实验误差忽略不计).
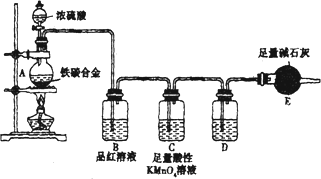
Ⅰ.探究浓硫酸的某些性质
(1)称量E的质量;按照图示连续装置,检查装置的气密性.
(2)将mg铁碳合金样品放入A中,再加入适量的浓硫酸.未点燃酒精灯前,A、B均无明显现象,其原因是:________.点燃酒精灯一段时间后,B中可观察到的明显现象是________.C中足量的酸性KMnO4溶液所起的作用是________.D中盛放的试剂是________.
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是________.
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg,则铁碳合金中铁的质量分数为________(写表达式).某同学认为:依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,你认为可能的原因是________.

(5)经过大家的讨论,决定采用下图装置和其他常用实验仪器测定某些数据即可,为了快速和准确地计算出铁的质量分数,最简便的实验操作是________(填写代号).
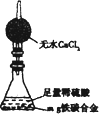
①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③测定反应前后装置和药品的总质量
查看答案和解析>>
科目: 来源:辽宁省抚顺市六校联合体2011届高三二模理综化学试题 题型:058
某校化学研究学习小组设计如下实验方案,测定小苏打样品中纯碱的质量分数.
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算.实验中反应化学方程式为________.
(2)方案二:按下图装置进行实验,已知B中盛放的是浓H2SO4.回答以下问题:
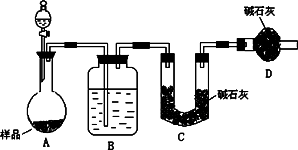
①实验加入药品前应先________________.分液漏斗中应该装________(填“盐酸”或“稀硫酸”).D装置的作用是________________.
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化.
③根据此实验得到的数据,测定结果有较大误差.因为实验装置还存在一个明显缺陷,该缺陷是________________.
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤、洗涤、干燥沉淀,称量固体质量,计算.
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器是________.
②若加入试剂改为氢氧化钡,已知称得样品9.5 g,干燥的沉淀质量为19.7 g,则样品中碳酸钠的质量分数为________(保留一位小数).
查看答案和解析>>
科目: 来源:江苏省南京市白下区2011届高三二模化学试题 题型:058
| |||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com