
科目: 来源:江苏省某重点中学2012届高三10月月考化学试题 题型:058
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
(1)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入________(写化学式).
(2)下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去).请根据图中信息写出t1时刻前该反应的离子方程式________.t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是________.

(3)该课题组对影响脱氮速率的因素提出了如下假设:
假设一:溶液的pH;
假设二:温度;
假设三:铁粉颗粒大小;…….
请你设计实验验证上述假设一,写出实验步骤及结论.(已知:溶液中的NO3-浓度可用离子色谱仪测定)
实验步骤及结论:________.
(4)氮的氧化物是造成大气污染的重要原因之一,氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+4NH3 5N2+6H2O 6NO2+8NH3
5N2+6H2O 6NO2+8NH3 7N2+12H2O
7N2+12H2O
NO
与NO2混合气体180 mol被8.90×103 g氨水(质量分数0.300)完全吸收,产生156 mol氮气.吸收后氨水密度为0.980 g/cm3.计算:①该混合气体中NO与NO2的体积比.
②吸收后氨水的物质的量浓度(答案保留1位小数)________.
查看答案和解析>>
科目: 来源:山西省太原五中2012届高三10月月考化学试题 题型:058
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
(1)该反应的化学方程式为________,每生成1 mol NF3,转移的电子数为________;生成物NF3中氮原子的杂化方式为________,NF3分子空间构型为________;
(2)N、F两种元素的氢化物稳定性比较,NH3________HF(选填“>”或“<”);
(3)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式________;
(4)氯化铜溶液中加入过量氨水,可以生成四氨合铜络离子,写出该反应的化学方程式________;
(5)元素A基态原子的核外电子排布式为
1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如图,该离子化合物的化学式为________.
查看答案和解析>>
科目: 来源:山西省太原五中2012届高三10月月考化学试题 题型:058
某化学研究性学习小组探讨
Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验.(1)提出猜想:
甲同学认为发生氧化还原反应,其反应的离子方程式为________;
乙同学认为发生双水解反应,其反应方程式为
2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;(2)实验验证:
丙同学设计了下列实验来探究反应的可能性.
①为了检验所用Na2SO3是否变质,应选用的试剂是________.
②取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成).
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色.
(3)得出结论:
①根据丙同学的实验得出的结论是:________;
②实验③中溶液变成血红色的离子方程式为________.
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是________.
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-________(填“大”或“小”)外,还有________.
查看答案和解析>>
科目: 来源:山东省曲阜一中2012届高三第一次摸底考试化学试题 题型:058
某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18 mol/L硫酸20 mL,纯铜粉足量,足量2 mol/L NaOH溶液
请根据实验回答问题:
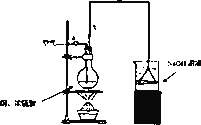
(1)烧杯中用NaOH溶液吸收的物质是:________(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:________.
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:________.
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全.然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中.在该实验装置中的________(填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用.
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行________、________、________后称量硫酸钡的质量为13.98 g,请计算能与铜反应的硫酸的最低浓度是________.
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:________,________.
查看答案和解析>>
科目: 来源:吉林省长春市十一高中2012届高三上学期期初考试化学试题 题型:058
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第一次考试化学试题 题型:058
现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉.现已知反应2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,温度稍高即发生副反应
Ca(ClO)2+CaCl2+2H2O,温度稍高即发生副反应
 5CaCl2+Ca(ClO3)2+6H2O.甲、乙、丙三人分别设计三个实验装置,如下图示:
5CaCl2+Ca(ClO3)2+6H2O.甲、乙、丙三人分别设计三个实验装置,如下图示:
(1)请从以下几个方面对上述甲、乙、丙三套装置的优缺点作出评析,并选择符合题目要求的选项填在表格内:
a.不容易控制反应速率
b.容易控制反应速率
c.有副反应发生
d.可防止副反应发生
e.污染环境
f.可防止污染环境
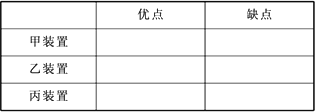
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向),组装一套较完善的实验装置(填编号)________.
(3)实验中若用12 mol/L的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol(假定各步反应均无反应损耗且无副反应发生),其可能的主要原因是________.
查看答案和解析>>
科目: 来源:河北省唐山一中2012届高三上学期第一次调研考试化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省无锡一中2012届高三9月初检测试题化学试题 题型:058
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干,焙烧除去水分得到粉体TiO2.
用现代分析仪器测定TiO2粒子的大小,用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为________.
(2)检验TiO2·xH2O中Cl-是否被除净的方法是________.
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号).

(4)滴定终点的现象是________.
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样wg,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为________.
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”).
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________.
查看答案和解析>>
科目: 来源:新人教版2012届高三上学期单元测试(5)化学试题 人教版 题型:058
铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.
实验中发生反应的化学方程式是________.
[实验步骤]
(1)称取5
.4 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中.为使其反应完全,则NaOH溶液的体积V≥________.(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”、“偏低”或“无影响”).
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1
.01×105 Pa)的体积.[问题讨论]
(1)同学们拟选用下列实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因________.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是________.
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了下图所示的实验装置.

①装置中导管a的作用是________.
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为________mL.
查看答案和解析>>
科目: 来源:山东省实验中学2012届高三第一次诊断性考试化学试题 题型:058
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101 kPa时,32.0 g N2H4在氧气中完全燃烧生成氮气,放出热量624 kJ(25℃时),N2H4完全燃烧反应的热化方程式是________.
(2)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.
肼-空气燃料电池放电时:
正极的电极反应式是________.
负极的电极反应式是________.
(3)下图是一个电化学过程示意图.
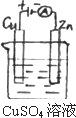
①锌片上发生的电极反应是________.
②假设使用肼一空气燃料电池作为本过程中的电源,铜片的质量变化128 g,则肼一空气燃料电池理论上消耗标标准状况下的空气________L(假设空气中氧气体积含量为20%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com