
科目: 来源:福建省福州八县(市)一中2012届高三上学期期中联考化学试题 题型:058
利用某炉渣(只含Fe2O3、FeO、SiO2、Al2O3)可制备新型净水剂碱式氯化铝[Al2(OH)nCl6-n]和Fe2O3.工艺流程如下:
①用3.00 mol/L的盐酸稀盐酸浸取炉渣,过滤.
②滤液先用H2O2氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3
③将第②步分离出沉淀的滤液通CO2调pH值后,保持温度在90~100℃进行“蒸发浓缩”,可以得到碱式氯化铝[Al2(OH)nCl6-n]
据以上信息回答下列问题:
(1)实验室配制3.00 mol/L的盐酸100 mL需要36.5%的浓盐酸(密度为1.2 g/cm3)________mL,配制用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、________.
(2)写出
H2O2与滤液反应的化学方程式________(3)
“蒸发浓缩”需保持温度在90~100℃,可采用的加热方法是________(4)
为验证炉渣中含有Fe2O3,做如下实验:a取适量炉渣于烧杯中,加足量________溶解、静置
b取上层清液少量于试管中,滴加________,观察现象.选用提供的试剂,
提供的试剂:
①稀硝酸
②稀硫酸
③氯水
④KMnO4溶液
⑤KSCN溶液
步骤a、b中所加试剂分别为________;
步骤b中反应的离子方程式:________
查看答案和解析>>
科目: 来源:山东省济宁市金乡二中2012届高三11月月考化学试题 题型:058
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.
[实验1]铜与浓硫酸反应,实验装置如图所示.

实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面.
(1)装置A中发生反应的化学方程式为________.
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是________.
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是________.
[实验2]实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:

(4)②中检验滤渣是否洗涤干净的实验方法是________.
(5)③中在煅烧过程中一定发生的反应的化学方程式为________.
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项)________.
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S
查看答案和解析>>
科目: 来源:安徽省淮南市二中2012届高三第三次月考化学试题 题型:058
某化学学习小组对铝与酸和碱的反应进行探究,过程如下.
实验Ⅰ:
(1)取形状、大小均相同的铝丝分别与等体积的、pH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的________(填写相应的字母);
a.盐酸的物质的量浓度大于硫酸的物质的量浓度
b.Cl-能促进此反应的进行
c.SO
42-能抑制此反应的进行d.硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分.
药品:氯化钠固体、硫酸钠固体、硫酸铜固体、氯化铜固体、6 mol/L盐酸、3 mol/L硫酸、18.4 mol/L硫酸、5 mol/L硝酸.
方案:取两支试管,分别加入形状、大小均相同的铝丝和等体积的________(填写相应的试剂,下同),再向其中的一支试管中加入适量的________固体并振荡使固体溶解,观察实验现象.
实验探究:略.
实验Ⅱ:
取足量的形状、质量均相同的铝丝分别与等体积的6 mol/L的盐酸、6 mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者________后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为________;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的.
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物.
(2)设计实验方案并完成相关实验:
将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,完成下列实验:
①向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解.实验时发现固体完全溶解,证明猜想________(填“1”、“2”、“3”、“4”)一定不正确.
②向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解.实验时发现固体完全溶解,证明猜想________(填“1”、“2”、“3”、“4”)一定不正确;
(3)得出结论
综合实验①②的现象,可推知猜想________(填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为:________.
查看答案和解析>>
科目: 来源:河北省冀州中学2012届高三上学期期中考试化学试题(A) 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省无锡市2012届高三上学期期中考试化学试题 题型:058
 TiOSO4+FeSO4+2H2O
TiOSO4+FeSO4+2H2O

回答下列问题:
(1)钛铁矿和浓硫酸反应属于________(选填“氧化还原反应”或“非氧化还原反应”);
(2)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是________;
2MgCl2+Ti在Ar气氛中进行的理由是________;
(3)上述生产流程中加人物质A的目的是防止Fe-2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物及可回收利用的物质是________.
(4)钛、氯气和过量焦炭在高温下反应的化学方程式________;
(5)如果取钛铁矿At,生产出钛Bt(不考虑损耗),则钛铁矿中钛的质量分数________(用A、B字母表示).
查看答案和解析>>
科目: 来源:江苏省无锡市2012届高三上学期期中考试化学试题 题型:058
PCl3可用于半导体生产的外延、扩散工序.有关物质的部分性质如下:

(一)制备
下图是实验室制备PCI3的装置(部分仪器已省略)

(1)仪器乙的名称________;
(2)实验室制备Cl2的离子方程式:________;
(3)碱石灰的作用是________,________;
(4)向仪器甲中通人干燥Cl2之前,应先通人一段时间的CO2,其目的是________.
(二)提纯
粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过________(填实验操作名称),即可得到PCl3的纯品.
(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的c1mol·L-l V1mL碘溶液,充分反应后再用c2mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗V2mL Na2S2O3溶液.
已知:H3PO3+H2O+I2 H3PO4+2HI;I2+2Na2S2O3
H3PO4+2HI;I2+2Na2S2O3 2NaI+Na2S4O6;假设测定过程中没有其他反应.
2NaI+Na2S4O6;假设测定过程中没有其他反应.
根据上述数据,该产品中PCl3的质量分数为________(用含字母的代数式表示、不必化简)
查看答案和解析>>
科目: 来源:安徽省师大附中2012届高三第四次模拟考试化学试题 题型:058
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂.某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加________,该过程的现象为:________.
(2)步骤②加入过量H2O2的目的:________.
(3)步骤③中反应的离子方程式:________.
(4)步骤④中一系列处理的操作步骤:过滤、________、灼烧、________、称量.
(5)若实验无损耗,则每片补血剂含铁元素的质量________g.
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.
(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需________.
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是________.
a.稀硝酸
b.稀硫酸
c.稀盐酸
d.浓硝酸
③滴定到终点时的颜色为________色.
查看答案和解析>>
科目: 来源:湖北省荆州中学2012届高三第二次质量检查化学试题 题型:058
某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
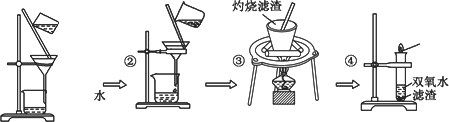
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、________、________.
(2)操作④的试管加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣含有MnO2,试管中发生反应的化学方程式:________.
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为________.
(4)已知氯化锌与稀氨水反应生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的[Zn(NH3)4](OH)2;下列是该同学对操作②的滤液主要成分进行探究的过程:
(一)[猜想Ⅰ]主要成分为氯化铵;
[验证(操作)过程]取少量滤液加入NaOH固体,并加热;
[实验现象]闻到有轻微的氨味;
[判断猜想]________(填“猜想Ⅰ成立”或“猜想Ⅰ不成立”);
(二)[猜想Ⅱ]主要成分为氯化锌;
[验证(操作)过程]________________
[实验现象]______________________;
[判断猜想]猜想Ⅱ成立;
由上述实验得出的结论是:滤液中的主次成分:________.
查看答案和解析>>
科目: 来源:浙江省东阳中学高三10月阶段性考试化学试题 题型:058
氢化钙固体登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙.

请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号);
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞________(请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成.
①写出CaH2与水反应的化学方程式________.
②该同学的判断不正确,原因是___________.
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象________.
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是________.
查看答案和解析>>
科目: 来源:河南省鄢陵二高2012届高三第一次月考化学试题 题型:058
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
提出假设:小组同学经过分析讨论认为生成气体可能含H2和SO2.
(1)认为生成气体中含H2的理由是________.
设计实验方案,验证假设:主要包括两个环节:
Ⅰ.验证SO2,实验装置如图所示;
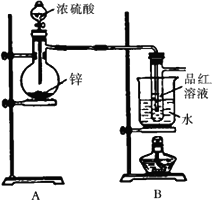
Ⅱ.检验产物中含有H2,实验内容为将由B部分导出的气体依次通过装置C、D、E、F.
(2)盛放锌粒的仪器名称是________.
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性.实验中操作及现象是________.
(4)Ⅱ中装置C、D、E、F、G的信息如下表所示:

①装置C、D的作用依次是________、________.
②E中发生反应的化学方程式是________.
③试剂X是________.
(5)有人提出方案Ⅱ在确认产物中存在H2并不严密,请你提出改进建议:________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com