
科目: 来源:62A22340_浙江省五校2012届高三第一次联考化学试题.doc 题型:058
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:


(1)如何检验如图所示装置的气密性:________.
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?________(填“可行”或“不可行”),原因是________.
(3)实验Ⅲ烧瓶中发生反应的化学方程式是________,打开开关K,产生的气体经验纯后点燃,现象是________.
(4)实验Ⅱ中量气管中的液体最好是________(填字母编号,下同)
a.浓NaOH溶液
b.氨水
c.煤油
d.饱和氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有________

(5)本实验应对量气管多次读数,读数时应注意:
①将实验装置恢复到室温,
②________,
③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)

根据上述数据,可计算出镁铝合金中铝的质量分数为________.
查看答案和解析>>
科目: 来源:江苏省南京市四校2012届高三12月月考化学试题 题型:058
过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下:

已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气.
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)检验“水洗”是否合格的方法是________;
(3)沉淀时常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①________;②________.
(4)测定产品中
CaO2的含量的实验步骤是:第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.[已知
:I2+2S2O32-=2I-+S4O62-]①CaO2
的质量分数为________(用字母表示);②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是________.
查看答案和解析>>
科目: 来源:山东省莱州一中2012届高三第二次质量检测化学试题 题型:058
实验室制NO及验证NO的性质,可以用如图所示的装置.请根据提示完成以下问题.已知反应:2NaOH+2NO2=NaNO2+NaNO2+H2O;2NaOH+NO+NO2=2NaNO2+H2O

Ⅰ.NO的制备
(1)在加药品之前首先应进行的操作是________(填操作名称),
(2)打开阀门K,取下活塞J向其中加入一小片铜片,装上活塞并推至底部.
(3)用注射器吸取适量的蒸馏水,然后倒立针筒,推动活塞J至底部以排尽装置内空气(装置内极少量的水不影响实验).
(4)将注射器插入稀HNO3中,吸取适量的稀HNO3,然后迅速关闭阀门K,请回答此时可能观察到的实验现象:________.
反应的离子方程式为:________,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K.
Ⅱ.NO性质实验
(1)观察注射器内气体呈________色,然后打开K,吸取适量空气后关闭K,此时注射器内气体呈________色,反应的化学方程式为:________.
(2)向下快速推动活塞J,注射器内气体颜色变化情况为:________,原因是________(结合化学方程式并配以必要的文字说明).
查看答案和解析>>
科目: 来源:山东省莱州一中2012届高三第二次质量检测化学试题 题型:058
“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率.
已知25℃,101 kPa时:C(s)+1/2O2(g)=CO(g);ΔH=-126 kJ·mol-1
2H2(g)+O2(g)=2H2O(1);ΔH=-571.6 kJ·mol-1;H2O(g)=H2O(1);ΔH=-44 kJ·mol-1
则在25℃,101 kPa时:C(s)+H2O(g)=CO(g)+H2(g);ΔH=________.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)![]() Fe(s)+CO2(g);ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263.
Fe(s)+CO2(g);ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,在这种情况下,该反应是否处于化学平衡状态?________(填“是”或“否”),其判断依据是________.
③目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);ΔH=-49.0 kJΔmol-1.现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH2OH(g)的浓度随时间的变化如图所示.
CH3OH(g)+H2O(g);ΔH=-49.0 kJΔmol-1.现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH2OH(g)的浓度随时间的变化如图所示.
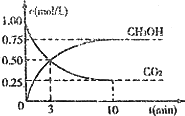
①从反应开始到平衡,氢气的平均反应速率v(H2)=________;
②下列措施能使![]() 增大的是________(填符号).
增大的是________(填符号).
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
查看答案和解析>>
科目: 来源:山东省济宁市邹城二中2012届高三第二次质量检测化学试题 题型:058
某研究性学生小组查阅资料得知
,漂白粉与硫酸溶液反应可制取氯气,化学方程式为: 他们设计了如图所示装置制取氯气并验证其性质的实验.
他们设计了如图所示装置制取氯气并验证其性质的实验.

试回答:
(1)该实验中A部分的装置是________(填写装置的序号);

(2)B中反应的化学方程式是________.
(3)写出C中反应的离子方程式________,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):________.
(4)写出在D装置中发生反应的离子方程式________.
(5)该实验存在明显的缺陷是________.
(6)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1 mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2![]() Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 200 mL.则该漂白粉中Ca(ClO)2的质量分数为________.
Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 200 mL.则该漂白粉中Ca(ClO)2的质量分数为________.
查看答案和解析>>
科目: 来源:山东省济宁市邹城二中2012届高三第二次质量检测化学试题 题型:058
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有________(填仪器名称),操作Ⅱ必须用到的仪器是________(填编号).
A.50 mL烧杯
B.50 mL量筒
C.25 mL碱式滴定管
D.25 mL酸式滴定管
(2)洗涤是洗去附着在沉淀上的________.(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________.
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3 g,则接下来还应进行的操作是________.
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是________.
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是________.(用化学方程式表示)
查看答案和解析>>
科目: 来源:浙江省富阳场口中学2012届高三11-12月教学质量检测化学试题 题型:058
2007年10月24日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥一号”探月卫星成功送入太空,迈出了向广寒宫求索的第一步.“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,第三级为液态氧燃料.
(1)常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂.但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体).
已知
:N2H4(g)+O2(g)![]() H2(g)+
H2(g)+![]() F2(g)=HF(g);ΔH=-269 kJ·mol-1
F2(g)=HF(g);ΔH=-269 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g);ΔH=-242 kJ·mol-1
O2(g)=H2O(g);ΔH=-242 kJ·mol-1
写出气态肼和氟气反应的热化学方程式:________.
(2)氢是一种理想的绿色能源,最近科学家利用太阳光分解水来制备氢.下图为光分解水制氢的循环系统,反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用.
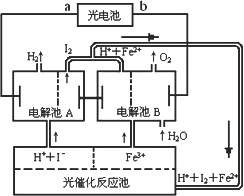
①判断光电池的a端为________极,b端为________极.
②写出电解池A中电极反应式:
阴极________,阳极________.
③电解池B中反应的离子方程式________.
④若电解池A中生成H2的体积为8.96 L(标准状况下),则电解池B中生成Fe2+的物质的量为________mol.
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第三次考试化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山东省济宁一中2012届高三第三次定时练习化学试题 题型:058
某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验.
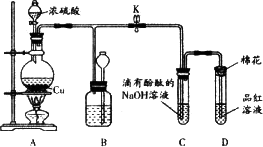
(1)装置D中试管口放置的棉花中应浸一种液体,这种液体是________,其作用是________.
(2)装置B的作用是贮存多余的气体.当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是________.B中应放置的液体是________(填字母).
a.水
b.酸性KMnO4
c.浓溴水
d.饱和NaHSO3
(3)取6.4 g铜片和12 mL 18.4 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余.某同学根据所学的化学知识认为还有一定量的硫酸剩余.
①有一定量的余酸但未能使铜片完全溶解,你认为原因是________
②下列药品能用来证明反应结束后烧瓶中确实有余酸的是________(填字母).
a.铁粉
b.银粉
c.碳酸氢钠溶液
d.氯化钡溶液
(4)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片和浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度.测定SO2的量的方案很多,下列方案可行的是________(填字母)
a.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置中产生的气体缓缓通入足量氢氧化钡溶液中,反应完全后过滤、洗涤、干燥、称量沉淀
c.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液中,反应完全后过滤,洗涤干燥、称量沉淀
查看答案和解析>>
科目: 来源:山东省济宁一中2012届高三第三次定时练习化学试题 题型:058
(1)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
①用化学符号表示下列4种微粒:
A:________;B:________;C:________;D:________.
②B微粒与D微粒结合质子(H+)的能力大小B________D(填大于、等于、小于)
(2)A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子.其中A和C都是由单原子形成的阴离子,B、D和E都是分了;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性.请回答:
①用化学符号表示上述5种微粒:
A________、B________、C________、D________、E________.
②在水溶液中A跟B反应的离子方程式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com