
科目: 来源:浙江省瑞安中学2012届高三10月月考化学试题 题型:058
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)请写出MnO2和浓盐酸制备Cl2的离子方程式________.
(2)反应Cl2+Na2SO3+2NaOH![]() 2NaCl+Na2SO4+H2O中的还原剂为________.
2NaCl+Na2SO4+H2O中的还原剂为________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO![]() .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO-;
假设3:________.
假设4:________
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3 moL·L-1 H2SO4、1 moL·L-1 NaOH、0.01 mol·L-1 KMnO4、淀粉-KI溶液、紫色石蕊试液.

查看答案和解析>>
科目: 来源:浙江省瑞安中学2012届高三10月月考化学试题 题型:058
下图中A、B均为固体,其中B为单质.下图可用于工业生产F,F是衡量一个国家化工水平的标志.回答下列问题:
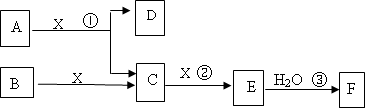
(1)A的化学式________
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,转移电子________mol
(3)写出D与铝单质反应的化学方程式________
(4)反应②是可逆反应,在2 L的密闭容器中投入4 mol C和3 mol X,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是________
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1 mol/(L·min)
C.当C和X的消耗速率比为2∶1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24 L气体C与0.15 mol氢氧化钠溶液反应的离子化学方程式________
(6)将5 mL 0.02 mol/L的F溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH是________写出F的一种用途________
查看答案和解析>>
科目: 来源:浙江省瑞安中学2012届高三10月月考化学试题 题型:058
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O.
Ⅱ.将FeSO4·7H2O配制成溶液.
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液.
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体.
Ⅴ.煅烧FeCO3,得到Fe2O3固体.
已知:NH4HCO3在热水中分解.
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是________.
(2)Ⅱ中,需加一定量酸,该酸最好是________.运用化学平衡原理简述该酸的作用________.
(3)Ⅲ中,生成FeCO3的离子方程式是________
若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是________.
(4)Ⅳ中,通过检验SO![]() 来判断沉淀是否洗涤干净,检验SO
来判断沉淀是否洗涤干净,检验SO![]() 的操作是________.
的操作是________.
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O22Fe2O3+4CO2.现煅烧464.0 kg的FeCO3,得到316.8 kg产品.若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg.(摩尔质量/g·mol-1:FeCO3116 Fe2O3160 FeO72)
查看答案和解析>>
科目: 来源:浙江省曹宅高级中学2012届高三上学期期中考试化学试题 题型:058
磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是________.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2每生成1 mol P4时,就有________mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL.该溶液中维生素C的物质的量是________mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+![]() I2+5SO42-+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如下表所示:
I2+5SO42-+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如下表所示:

该实验的目的是________;表中V2=________mL
稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(5)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是________.
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
□Ce3++□H2O2+□H2O![]() □Ce(OH)4↓+□________
□Ce(OH)4↓+□________
查看答案和解析>>
科目: 来源:广西桂林中学2012届高三11月月考化学试题 题型:058
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
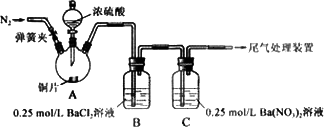
实验操作和现象:
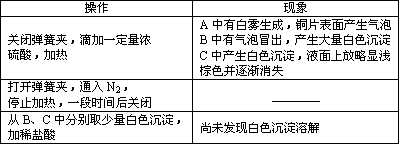
(1)A中反应的化学方程式是________.
(2)C中白色沉淀是________,该沉淀的生成表明SO2具有________性.
(3)C中液面上方生成浅棕色气体的化学方程式是________.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气中成分共同作用,乙认为是只有白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是________.
②进行实验,B中现象:
![]()
检验白色沉淀,发现均不溶于稀盐酸.结合离子方程式解释实验现象异同的原因:________.
(5)合并(4)中两同学的方案进行试验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是________.
查看答案和解析>>
科目: 来源:山东省济宁市鱼台二中2012届高三11月月考化学试题 题型:058
Ⅰ、一无色透明的溶液做如下实验:
ⅰ取少量溶液滴加盐酸酸化的BaCl2溶液,只观察到有白色沉淀生成.
ⅱ另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示:
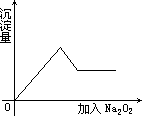
试问:
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、CO32-、K+、SO42-等离子中一定存在的离子是________、________、________;可能存在的离子是________、________;一定不存在的是________、________、________、________.
(2)上述溶液至少由________、________等物质混合成.(填化学式)
Ⅱ、甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g).部分物质的燃烧热数据如下表:
CO(g)+3H2(g).部分物质的燃烧热数据如下表:

已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量.
(1)写出CO燃烧的热化学方程式________.
(2)2H2(g)+O2(g)![]() 2H2O(g) ΔH=________kJ/mol
2H2O(g) ΔH=________kJ/mol
查看答案和解析>>
科目: 来源:浙江省东阳市南马高中2011届高三下学期期中考试化学试题 题型:058
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.
Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图如所示.
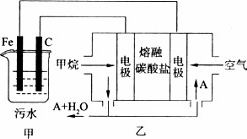
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时应向污水中加入适量的________.
a.HCl
b.CH3CH2OH
c.Na2SO4
d.NaOH
(2)电解池阳极实际发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是Ⅰ.________;Ⅱ.________.
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.正极的电极反应是________;
(4)已知燃料电池中有1.6 g CH4参加反应,则C电极理论上生成气体________L(标准状况).
(5)若将装置中的甲部分换为如图所示的装置,电解足量CuSO4,电解后加入________可能恢复至原浓度.
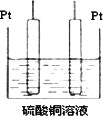
查看答案和解析>>
科目: 来源:山东省潍坊三县2011届高三阶段性教学质量检测化学试题 题型:058
Ⅰ以下是有关SO2、Cl2的性质实验.
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
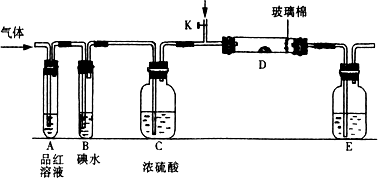
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?________(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为________.
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为________.
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)________,仍然无法观察到沉淀产生.
A.氨水
B.稀盐酸
C.硝酸钾溶液
D.硫化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式________.
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO2的电极为________极,其电极反应式为________;电池的总反应式________

Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是________(填序号)
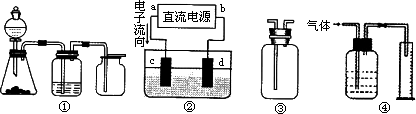
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正扳,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
Ⅲ用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是________(填序号)
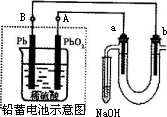
A.铅蓄电池负极的反应式为:Pb-2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
查看答案和解析>>
科目: 来源:山东省济宁市一中2011届高三一轮复习质量验收化学试题 题型:058
Ⅰ无水氯化铝是某些有机化学反应中常用的催化剂,它的熔点190℃,但在180℃时已开始升华.它在常温下是一种白色固体,遇水发生剧烈的水解反应,甚至在空气中遇到微量水汽也强烈地发烟.用下列装置制取无水氯化铝:
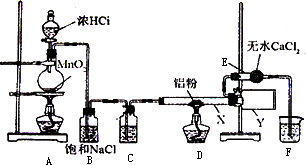
回答以下问题:
(1)装置D中发生的化学反应方程式:________.
(2)仪器X与仪器Y直接相连的意图是:
①收集产物
②________.
(3)能否去掉E装置________原因是________.
(4)实验时应先点燃________处的酒精灯,其作用是________.
Ⅱ.某种胃药中止酸剂为CaCO3.为测定其中CaCO3的含量,某化学小组设计了以下方案(药片中的其他成分与HCl和NaOH溶液均不反应):
用滴定法测定,有以下几步操作:
A.配制0.100 mol/L HCl溶液和0.100 mol/L NaOH溶液
B.取一粒药片(0.100 g),研碎后加入20.0 mL蒸馏水
C.以酚酞为指示剂用0.100 mol/L NaOH溶液滴定,用去NaOH溶液VmL时达到终点
D.用酸式滴定管加入25.00 mL 0.100 mol/L HCl溶液,充分反应
请回答有关问题:
(1)测定过程的正确操作顺序为________(填字母).
(2)经测定,每次消耗NaOH溶液体积的平均值为13.00 mL,则该胃药中CaCO3的质量分数是________.
查看答案和解析>>
科目: 来源:江西省吉安三中2011届高三上学期期中考试化学试题 题型:058
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).

请按要求填空:
(1)仪器甲的名称是________;
(2)利用B装置可制取的气体有________;(写出一种即可).
(3)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:

请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理的请直接说明理由
实验Ⅰ________
实验Ⅱ________.
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a和b,再打开止水夹c,使烧杯中的水进入试管丁的操作是
________.
②试管丁中集满NO2,再与水充分反应后,向试管内缓缓通入一定量的氧气,直到试管内全部充满水,则所得溶液中溶质的物质的量浓度是________mol/L(气体按标准状况计算).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com