
科目: 来源:福建省四地六校2012届高三期中联考试题化学试题 题型:058
碘在工农业生产和日常生活中有重要用途.

(1)上图为海带制碘的流程图.步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________(从下列仪器中选出所需的仪器,用标号字母填写).
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
步骤④发生反应的离子方程式为________.
若步骤⑤采用四氯化碳来提取碘,将四氯化碳加入含碘水溶液并振荡,将观察到的现象是________.
操作⑥可用的方法是:________.
A、加碱洗涤法
B、过滤法
C、萃取分液法
D、蒸馏或分馏法
(2)溴化碘(IBr)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟水反应的方程式为:IBr+H2O=HBr+HIO等,下列有关IBr的叙述中错误的是:________.
A.跟溴、碘相似,固体溴化碘熔沸点也很低
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr、NaIO和H2O
(3)为实现中国消除碘缺乏病的目标.卫生部规定食盐必须加碘盐,其中的碘以碘酸钾(KIO3)形式存在.可以用硫酸酸化的碘化钾淀粉溶液检验加碘盐,请写出反应的离子方程式:________.
查看答案和解析>>
科目: 来源:黑龙江省大庆铁人中学2012届高三上学期期中考试化学试题 题型:058
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置.
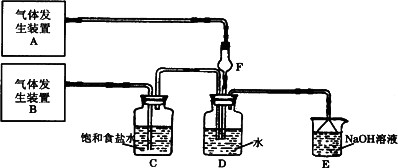
(1)气体发生装置A产生的气体是________;
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化铁溶液
②氯化亚铁溶液
③硫氰化钾溶液
④苯酚溶液
⑤品红溶液
⑥酸性高锰酸钾溶液
Ⅰ:若Cl2过量:取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,再加入________(选填一个序号)试剂,实验现象是:________;
Ⅱ:若SO2过量:取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,实验现象是:________;
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol/L碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为________.
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式________.
查看答案和解析>>
科目: 来源:辽宁省辽南协作体2012届高三上学期期中考试化学试题 题型:058
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为________.
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示.
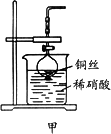
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)
A.铁
B.铝
C.铂
D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________(写化学方程式).
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO.反应开始时,可以在U形管右端观察到无色的NO气体.
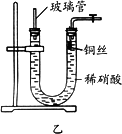
长玻璃管的作用是________.
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下________mL O2才能使NO全部溶于水.
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是________.
甲:铜![]() 硝酸铜
硝酸铜
乙:铜![]() 硝酸铜
硝酸铜
丙:铜![]() 氯化铜
氯化铜![]() 硝酸铜
硝酸铜
丁:铜![]() 氧化铜
氧化铜![]() 硝酸铜
硝酸铜
查看答案和解析>>
科目: 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
高分子材料M在光聚合物和金属涂料方面有重要用途.
已知:①磷酸的结构式为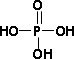
②M的结构为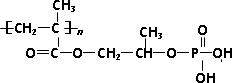
M可以用丙烯为原料,通过如下图所示的路线合成:
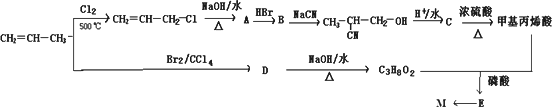
回答下列问题:
(1)写出E中两种官能团名称________和________.
(2)C→甲基丙烯酸的反应类型为________.
(3)符合下列条件的甲基丙烯酸的链状同分异构体数目为________(含甲基丙烯酸).
①能与溴水反应褪色;②与Na2CO3溶液反应放出CO2气体
(4)A→B的反应中还可能生成一种有机副产物,该副产物的结构简式为________.
(5)请用反应流程图表示A→丙烯酸的合成线路,并注明反应条件
(提示:氧化羟基的条件足以氧化C=C).
例:由乙醇合成聚乙烯的反应流程图可表示为:
![]()
查看答案和解析>>
科目: 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
重晶石矿石主要含有BaSO4,还含有少量的SiO2、Al2O3、Fe2O3、MnO2、FeS2、Na2O、K2O等杂志.以下是某工业制备硫酸钡以及分离某些金属的流程图.
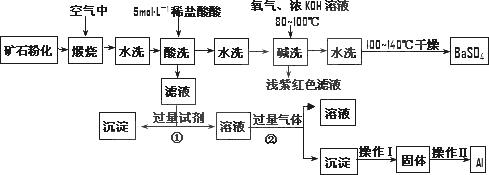
(1)煅烧过程中产生的污染性气体主要是________.
(2)确定第一次水洗液中有K+存在的实验现象是________.
(3)写出碱洗时的氧化还原反应方程式________.
(4)①反应生成沉淀的化学式________,②反应的离子方程式为________.
(5)操作Ⅰ为________ ,操作Ⅱ为________.
查看答案和解析>>
科目: 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作反应的催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
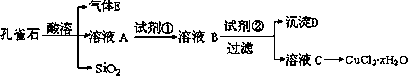
已知:Ⅰ.Cu(OH)2、CuO开始分解的温度分别为80℃和900℃.
Ⅱ.有关金属离子从开始沉淀到沉淀完全时溶液的pH:
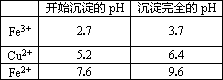
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①最好为________(填字母).
a.(NH4)2S
b.H2O2
c.NaClO
d.Cl2
(2)加试剂②的目的是________,由溶液C获得CuCl2·xH2O,需要经过加热浓缩、________、过滤等操作.
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,有如下两种实验方案:
方案一:称取a g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的
质量为b g.
方案二:称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀(控制温度约为120℃)至质量不再减轻为止,称量所得固体的质量为bg.
则上述方案中不合理的是________,原因是________.
依据合理方案计算得x=________(用含a、b的代数式表示).
查看答案和解析>>
科目: 来源:甘肃省陇东中学2012届高三第四次模拟考试化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:甘肃省陇东中学2012届高三第四次模拟考试化学试题 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:甘肃省陇东中学2012届高三第四次模拟考试化学试题 题型:058
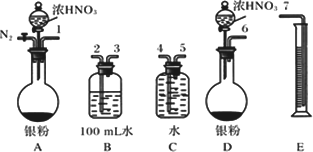
陇东中学高三2、4班学生设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO.其实验流程图如下:

(1)测定硝酸的物质的量
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示.在B容器中生成硝酸的物质的量为________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为________.
(2)测定NO的体积
①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是________.
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是________(填各导管口编号).
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置________(选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平.
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO产生,作此判断的依据是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com