
科目: 来源:山东省潍坊市重点中学2012届高三2月月考化学试题 题型:058
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:?
(1)以天然气为原料制H2是合成氨的一条重要的路线.甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) ΔH1=-35.6 kJ·mol-1
试判断常温下,上述反应能否自发进行:________(填”能”或”否”).有研究认为甲烷部分氧化的机理为:
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2=-890.3 kJ·mol-1
③CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH3=247.3 kJ·mol-1
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:
________.
(2)恒温下,向一个2 L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
实验数据
此条件下,该反应达到化学平衡时,氮气的浓度为________.
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.?

①b处电极上发生的电极反应式是________.
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________.
③若完全反应后,装置Ⅱ中阴极质量增加12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下).
查看答案和解析>>
科目: 来源:福建省莆田一中2012届高三第一学段考试化学试题(人教版) 题型:058
某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色.查阅资料显示:溴水是溴(Br2)的水溶液,呈黄色;溴水中含有溴单质.
(1)提出问题:Fe3+、Br2,谁的氧化性更强.
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含________所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;
b、CCl4;
c、无水酒精;
d、KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
(4)结论:氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为________
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是________(填离子的化学式).
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________.
查看答案和解析>>
科目: 来源:江苏省泰州中学2012届高三上学期期中考试化学试题(人教版) 题型:058
某同学利用铁与水蒸气反应后的固体物质进行了如下实验:
(1)固体溶于稀盐酸的化学方程式为________;
(2)试剂1的化学式是________;加入试剂1后呈红色的原因是(用离子方程式表示):________.
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)________;
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?

为验证乙同学的猜想合理与否?请同学们根据结论完成下表的实验设计方案.可选用试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、0.1 mol·L-1 FeCl3、0.1 mol·L-1 CuSO4、20%KSCN、蒸馏水.
![]()
查看答案和解析>>
科目: 来源:江苏省泰州中学2012届高三上学期期中考试化学试题(人教版) 题型:058
照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子.某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴.(已知:4H++2[Ag(S2O3)2]3-=Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)
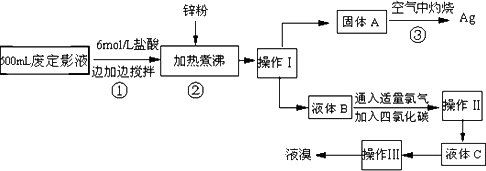
(1)操作Ⅲ的名称是________;操作Ⅱ需要的主要玻璃仪器有________.
(2)加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为________.
(3)液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是________.
(4)步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是________.
(5)通过上述回收银的流程中,从绿色化学的要求看,存在的不足为________.
查看答案和解析>>
科目: 来源:山东省潍坊市四县一校2012届高三上学期模块监测考试化学试题(人教版) 人教版 题型:058
2010年8月7日,甘肃甘南藏族自治州舟曲县发生大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行分析,并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应实验,只有B、C含有钾离子.
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出B、C、D的化学式:B________、C________、D________.
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________.
(3)写出实验②发生反应的离子方程式________.
(4)C常用作净水剂,用离子方程式表示其净水原理________.
查看答案和解析>>
科目: 来源:山东省潍坊市四县一校2012届高三上学期模块监测考试化学试题(人教版) 人教版 题型:058
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
提供的试剂:研细的钙片粉末(钙片中的其他成分不与盐酸反应)、2 mol·L-1盐酸、5% NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液和蒸馏水.
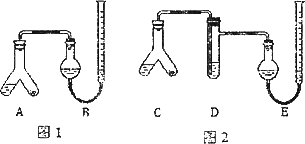
实验过程:
Ⅰ.检查两套装置的气密性.
Ⅱ.在A、C的右边加入0.25 g钙片粉末,左边加入3 mL 2 mol·L-1盐酸,塞紧塞子.在B、E中均加入饱和NaHCO3溶液,如图所示,记下量气管读数.
Ⅲ.将A、C倾斜,使液体与固体混合,实验结束并冷却后读出量气管读数,测得B中收集到的气体为41.90 mL,E中收集到的气体体积为39.20 mL(以上气体体积均已折算为标准状况下的体积).
回答下列问题:
(1)Ⅰ中检查图1装置气密性的万法是________.
(2)A中发生反应的离子方程式为________;D中加入试剂为________,D的作用是________.
(3)实验前左右两管液面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是________.
(4)图2实验所得钙片中的碳酸钙的质量分数为________;图1实验比图2实验所得钙片中的碳酸钙含量偏高,用离子万程式表示偏高的原因________.
查看答案和解析>>
科目: 来源:安徽省淮北一中2012届高三第三次月考化学试题(人教版) 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省惠安高级中学2012届高三第三次月考化学试题 题型:058
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积.将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量.
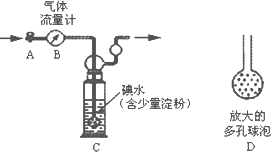
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:________.
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:________.
(3)本实验的关键在于关闭气体流量计的时机,请问应当在什么时候关闭活塞A:________.
乙方案:实验步骤如以下流程图所示:
(4)写出步骤①中反应的化学方程式________.
(5)如何判断步骤②中沉淀是否完全的方法是________.
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为________(用含有V、m的代数式表示).
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同.
(7)你认为丙方案是否合理,说明理由:________.
查看答案和解析>>
科目: 来源:福建省惠安高级中学2012届高三第三次月考化学试题 题型:058
下表是实验室制备气体的有关内容:
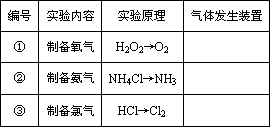
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________.
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中.

(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质:
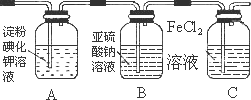
①通入氯气后,A中的现象是________,整套实验装置存在的明显缺陷是________.
②C装置中发生反应的离子方程式为:________.
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):_______________.
(4)若用排空气法收集Cl2,在下边方框内画出气体收集装置图.

查看答案和解析>>
科目: 来源:福建省四地六校2012届高三期中联考试题化学试题 题型:058
某校化学研究性学习小组的同学在学习了氨的性质持讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式________;
(2)在实验室中,还可以用浓氨水与________(填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气.你认为能否达到目的?________(填“能”或“否”),理由是________.
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
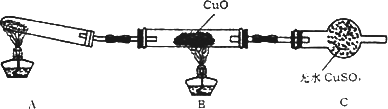
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是________.
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体.写出氨气与CuO反应的化学方程式:________.
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+![]() Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O.________.
Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O.________.
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A.冷却后称量,A的质量为72 g.据此可推得,A的化学式为________.由此,得到的结论是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com