
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:058
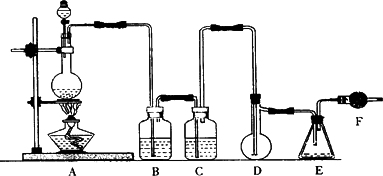
某化学兴趣小组设计如下实验验证乙醇的催化氧化及产物(图中固定仪器未画出,“Δ”表示酒精灯加热),A处为无水乙醇(沸点78℃);B处为绕成螺旋状的细铜丝;C处为无水硫酸铜粉末;D处为碱石灰;E处为干燥的KMnO4;F处为新制的碱性Cu(OH)2悬浊液.试回答下列问题:

(1)在上述装置中,实验时需要加热的仪器是________(填字母).E处发生反应的化学方程式为________.
(2)若要保证此实验有较好的效果,常采用的方法是________,还需要补充的玻璃仪器有________,________.
理由是________.
(3)能检验乙醇反应后所得的产物的实验现象是________.
(4)F中发生反应的化学方程式为________.
(5)实验中若撤去E部分,其他操作不变,则C处无明显变化,F中现象与⑶相同,推断此条件下硬质玻璃管中主要的化学方程式是________.
查看答案和解析>>
科目: 来源:江苏省徐州市2012届高三考前信息卷化学试题 题型:058
肉桂酸是生产冠心病药物“心可安”的重要中间体.它常在无水醋酸钾或无水碳酸钾的存在下,以苯甲醛和醋酸酐为原料制备.

以苯甲醛和醋酸酐为主要原料制备肉桂酸的实验步骤为:
①在100 mL干燥的圆底烧瓶中如入1.5 mL新蒸馏过的苯甲醛、4 mL新蒸馏过的醋酸酐以及研细的2.2 g无水碳酸钾、2粒沸石,按图l所示连接好装置.
②加热回流(小火加热)40 min,火焰由小到大使溶液刚好回流.
③停止加热,待反应物冷却.
④用热水溶解反应后产物,用图2所示装置进行水蒸气蒸馏、10%NaOH溶解、活性炭脱色、冷却得到白色粗产品A.
⑤用水-乙醇重结晶得白色晶体B.

(1)整个回流装置要干燥,原因是________.
(2)回流时,反应温度不能太高的原因是________.
(3)在实验中要多次用到抽滤.下列有关抽滤的说法中,正确的是________.(填字母)
A.抽滤时,滤纸的大小应与布氏漏斗底部恰好一样
B.抽滤前先用溶剂将滤纸湿润,使滤纸与漏斗底部贴紧
C.抽滤结束时应先关抽气泵,后抽掉抽滤瓶接管
D.抽滤是利用抽气泵使抽滤瓶中的压强降低,达到固液分离的目的
(4)甲为水蒸气发生器,装置中T型管长度尽可能短一些,且靠近水蒸气发生器一端稍向下倾斜,这样做的原因是________.
(5)白色粗产品A中所含主要杂质为________.
(6)若某同学得到白色片状晶体1.2 g,试计算其产率为________(保留3位有效数字).
查看答案和解析>>
科目: 来源:江苏省徐州市2012届高三考前信息卷化学试题 题型:058
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图1所示装置模拟工业制取并收集ClO2.
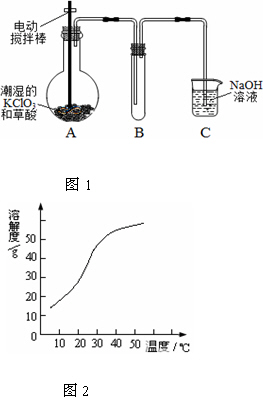
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:________.
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有________;B也必须添加温度控制装置,应该是________装置.
(3)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2.根据图2所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
①________;②________;③洗涤;④干燥.
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL.(已知2 Na2S2O3+I2=Na2S4O6+2NaI)
①滴定过程中,至少须进行两次平行测定的原因是________.
②原ClO2溶液的浓度为________g/L(用含字母的代数式表示).
查看答案和解析>>
科目: 来源:天津市耀华中学2012届高三第一次模拟考试化学试题 题型:058
某课外小组同学用下图所示装置在实验室制各氯气并探究其相关性质(夹持设备已略).

(1)制备氯气选用的药品为:漂白粉固体和浓盐酸,相关的化学反应方程式为________.
(2)装置B的作用之一是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象________.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中①、②、③依次放
入________(选填字母).

(4)设计装置D、E的目的是比较氯、溴、碘的菲金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为________色,说明氯的非金属性大于溴;之后打开活塞,将装置D中少量溶液加入装置E中,振荡;观察到的现象是________,则说明溴的非金属性大于碘.
(5)有同学提出该实验方案仍有不足,请说明其中两点不足及原因是:
①________;
②________.
查看答案和解析>>
科目: 来源:辽宁省葫芦岛一高中2012届高三上学期第一次月考化学试题 题型:058
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为∶2Na2O2+2CO2![]() 2Na2CO3+O2.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95 g过氧化钠样品为原料,制取O2,设计出如下实验装置∶
2Na2CO3+O2.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95 g过氧化钠样品为原料,制取O2,设计出如下实验装置∶
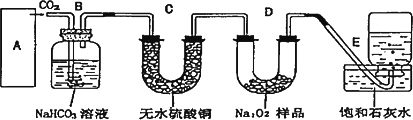
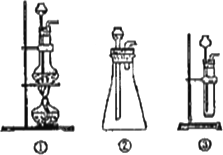
(1)A中制取CO2的装置,应从下列图①、②、③中选哪个图∶________
B装置的作用是________,C装置内可能出现的现象是________.为了检验E中收集到的气体,在取出集气瓶后,用________的木条伸入集气瓶内,木条会出现________.
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因∶________.
(3)若D中的1.95 g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
________.
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250 mL,又知氧气的密度为1.43 g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值________(答大或小),相差约________mL(取整数值,所用数据均在标准状况下测定),这是由于________.
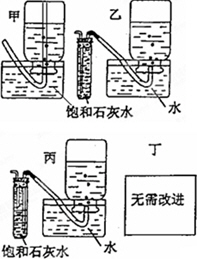
(5)你认为上述A-E的实验装置中,E部分是否安全、合理?E是否需要改为下列四项中的哪一项∶________.(用甲、乙、丙、丁回答)
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三下学期质量检测(三)化学试题 题型:058
茶是我国人民喜爱的饮品.某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素.
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1.
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是________;
(2)写出检验Ca2+的离子方程式________;
(3)写出沉淀C所含主要物质的化学式________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式________;
(5)步骤⑨的作用是________;
(6)猜测步骤⑩的目的是________;
(7)已知:2Fe(s)+3/2O2(g)=Fe2O3(s),ΔH=-Q1 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s),ΔH=-Q2 kJ·mol-1
则Q1________Q2(填“>”,“<”或“=”)
查看答案和解析>>
科目: 来源:上海市嘉定区2013年高考一模化学试题 题型:058
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638 g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置.
试回答下列问题:
1、装置A中发生反应的化学方程式为________.
2、装置B、C应盛放的药品分别是________、________.
3、实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是________.
4、实验时,D装置需加热至50-59℃.最好采用的措施是________、如何防止E中液体挥发?________.
5、F装置中干燥管内所盛物质是________,作用是________.
6、由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为________.
查看答案和解析>>
科目: 来源:上海市奉贤区2013年高考一模化学试题 题型:058
镁、铝、铁及其化合物在生产和生活中有广泛的应用.
1.镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2 mol/L稀硫酸中生成0.2 mol氢气,计算并确定镁铝合金中物质的量n(Mg)∶n(Al)=________.
2.硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料.取某硫铁矿10 g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4 g(杂质SiO2不反应).该硫铁矿中FeS2的质量分数为________.
3.现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是________.

4.炼铁厂生产的生铁常用于炼钢.取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况下).
(1)计算此钢样粉末中铁和碳的物质的量之比为________(最简单的整数比).
(2)再取三份不同质量的上述钢样粉末分别加到100 mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
则该硫酸溶液的物质的量浓度为________.
(3)若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为________g.(保留3位小数)
查看答案和解析>>
科目: 来源:上海市奉贤区2013年高考一模化学试题 题型:058
化学学习中,有关物质性质的学习离不开实验,请阅读下列对应的内容,并按要求完成填空.
1.实验室经常用烧杯进行性质实验研究,如用下图所示装置及下表中试剂,过一段时间
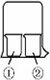

实验1、2、3、4烧杯①中的现象分别是________,________,________,________,
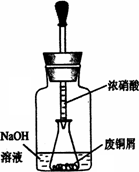
2.用下图装置:废铜屑制硝酸铜,反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有________(填写化学式)
3.浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题.
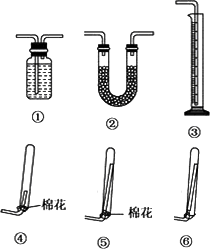
(1)若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是________.收集干燥的NH3,收集装置应选择(填装置序号)________,理由是________.
(2)向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1-10 nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式________.
4.下图是苯与溴发生反应并进行产物检验的反应装置
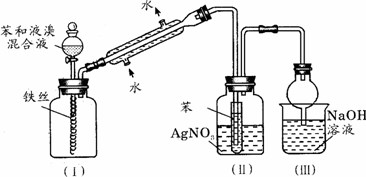
实验装置中的冷凝管“左低右高”的放置目的是________,整套实验装置中能防止倒吸的装置是________(填装置序号)
对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫.
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠.
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠.
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎.
②将研钵中的样品露置在空气中两天.
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡.
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少.
5.解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)________.
6.如果要验证③是否成立的实验方法是________.
查看答案和解析>>
科目: 来源:上海市宝山区2013年高考一模化学试题 题型:058
某草酸盐晶体KxFey(C2O4)z·wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7.取该晶体做了以下实验:
①取4.910 g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
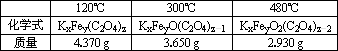
加热到300℃以上时,还生成了一种不常见的碳的氧化物气体(用R表示);
②另取4.910 g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为Fe2O3,质量为0.800 g.
1.计算得出草酸盐晶体中结晶水的质量分数为________(保留三位小数);
2.R的化学式为________;
3.草酸盐晶体的摩尔质量为________;
4.试通过计算,确定草酸盐晶体的化学式.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com