
科目: 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目: 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目: 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目: 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目: 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目: 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目: 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目: 来源:湖南省长沙市一中2010届高三第四次月考、化学试卷 题型:058
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.(装置气密性已检查完毕).
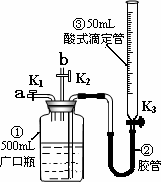
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作:________;
②从导管a通入一定量的NO,并记录滴定管液面变化的示数为VL(V<50 mL,气体体积已换算为标准状况).准确测定NO的体积的主要操作:________;
(2)验证NO的还原性;探究工业生产硝酸的原理
①、停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可观察到的现象是________,写出对应现象的化学反应方程式________、________;
②、继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体.
ⅰ当通入氧气的体积为![]() 时,则广口瓶①的气体体积为________;
时,则广口瓶①的气体体积为________;
ⅱ当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为________mol/L.
查看答案和解析>>
科目: 来源:上海市浦东新区2012届高三4月(二模)质量抽测化学试题 题型:058
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:上海市长宁区2013年高考一模化学试题 题型:058
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如下图所示).

1.制备实验开始时,先检查装置气密性,接下来的操作依次是(填序号).
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
制备反应会因盐酸浓度下降而停止.为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案∶
甲方案∶与足量AgNO3溶液反应,称量生成的AgCl质量.
乙方案∶与已知量CaCO3(过量)反应,称量剩余固体的质量.
丙方案∶与足量Zn反应,测量生成的H2体积.
继而进行下列判断和实验∶
2.判定甲方案不可行,理由是________.
3.乙方案的实验发现,固体中含有MnCO3,说明碳酸钙在水中存在________,测定的结果会∶(填“偏大”、“偏小”或“准确”).
进行丙方案实验∶装置如下图所示(夹持器具已略去).

4.使Y形管中的残余清液与锌粒反应的正确操作是将转移到________中.
5.反应完毕,每间隔1分钟读取气体体积,发现气体体积逐渐减小,直至不变.气体体积逐次减小的原因是________(排除装置和实验操作的影响因素).
6.小组内又有同学提出还可采用酸碱中和滴定法测定残余液中盐酸的浓度,但还需经查阅资料知道∶________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com