
科目: 来源: 题型:单选题
500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液恰好反应完全;另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
| A.(l0b - 5a) mol/L | B.(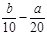 )mol/L )mol/L |
C.(5b一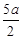 )mol/L )mol/L | D.(2b—a)mol/L |
查看答案和解析>>
科目: 来源: 题型:单选题
下列有关阿伏伽德罗常数说法正确的是
| A.含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NA |
| B.标况下,22.4L四氯化碳所含分子数大于NA |
| C.0.1mol/L 的AgNO3溶液中,阳离子所带正电荷数目为0.1NA |
| D.电解267g熔融AlCl3,能生成3mol Cl2和54g金属铝 |
查看答案和解析>>
科目: 来源: 题型:单选题
向22.4g的Fe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
| A.6.4g | B.4.8g | C.2.4g | D.1.6g |
查看答案和解析>>
科目: 来源: 题型:单选题
用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
| A.11.2g Fe投入到400mL 1mol/L的硝酸中充分反应,转移电子总数为0.2NA |
| B.标准状况下,11.2L C2H6含3NA个C—H极性共价键 |
| C.标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA |
| D.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |
查看答案和解析>>
科目: 来源: 题型:单选题
用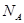 表示阿伏加德罗常数的值。下列叙述中不正确的是
表示阿伏加德罗常数的值。下列叙述中不正确的是
A.足量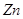 与一定量的浓硫酸反应,产生 与一定量的浓硫酸反应,产生 (标况)气体时,转移的电子数为 (标况)气体时,转移的电子数为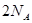 |
B.一定条件下,32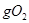 和足量的铁粉充分反应,转移的电子数为 和足量的铁粉充分反应,转移的电子数为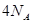 |
C.4.6g乙醇和甲酸(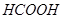 )的混合物中含有的碳原子数在 )的混合物中含有的碳原子数在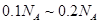 之间 之间 |
D.分子总数为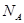 的NO和 的NO和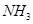 混合气体中含有的氮原子数为 混合气体中含有的氮原子数为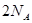 |
查看答案和解析>>
科目: 来源: 题型:单选题
设NA为阿伏加德罗常数的值,下列叙述错误的是( )。
| A.18 g H2O中含有的质子数为10NA |
| B.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| C.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| D.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA |
查看答案和解析>>
科目: 来源: 题型:单选题
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液
甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )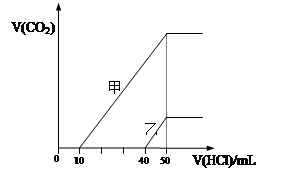
| A.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
| B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为: OH-+H+=H2O |
| C.乙溶液中含有的溶质是NaOH、NaHCO3 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况) |
查看答案和解析>>
科目: 来源: 题型:单选题
在一定条件下,将8 g CH4和O2组成的混合气体充入一体积固定的密闭容器(容器内有足够的Na2O2固体),此时容器内压强为P1,用电火花不间断地点燃,使其充分反应,恢复至原温度,结果固体增重3.2 g,此时容器内压强为P2。则P1:P2为( )
| A.3:2 | B.2:1 | C.5:2 | D.5:3 |
查看答案和解析>>
科目: 来源: 题型:单选题
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA |
| B.l L 0.1mol·L-1的H2SO3溶液中含有H+的数目为0.2NA |
| C.100mL 3 mol·L-1盐酸与11.2g Fe充分反应转移0.2NA个电子 |
| D.在标准状况下,22.4 L空气中约含有NA个气体分子 |
查看答案和解析>>
科目: 来源: 题型:单选题
现有两份体积相同的混合溶液,其组成如下:
| | KCl | K2SO4 | ZnSO4 | ZnCl2 |
| (1) | 0.4 mol | 0.1mol | 0.3mol | 0.1mol |
| (2) | 0.2mol | 0.2mol | 0.1mol | 0.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com