
科目: 来源: 题型:填空题
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是 。
(2)混合气体的平均摩尔质量是 。
(3)CO2和CO的体积之比是 。
(4)CO的体积分数是 。
(5)CO2和CO的质量之比是 。
(6)CO的质量分数是 。
(7)混合气体中所含氧原子的物质的量是 。
(8)混合气体中所含碳原子的物质的量是 。
查看答案和解析>>
科目: 来源: 题型:填空题
尽管氮元素在地壳中的丰度较低(主要以硝酸盐的形式存在),在所有元素中仅排31位,但是大气中有丰富的氮气,这为氨和硝酸的广泛应用提供了可能。
(1)氮气的电子式为 ,雷电作用能进行氮的固定,写出反应方程式 。
(2)食物蕴含的营养物质中,含氮的高分子化合物是 (填名称),其水解的最终产物为 。
(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3﹣,写出其离子方程式: 。
(4)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。①滤液显深蓝色是因为含有的离子(填化学式). 。②若沉淀质量为7.8g,则合金的质量为 g。
查看答案和解析>>
科目: 来源: 题型:填空题
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
⑴工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 ;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
⑵铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
查看答案和解析>>
科目: 来源: 题型:填空题
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:
__________________________________________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为____________________。与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_____________________,该电池总反应的离于方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如图
所示。请回答下列问题:
(1)b点时M的组成成分为______________________。
(2)若要使b点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳________L(标准状况下)。
(3)若向生成的7.16 g盐的溶液中加入一定量的某物质,充分反应后,减压低温蒸发得到纯净的碳酸钠固体(无结晶水)8.4 g。
①若只加入0.03 mol某物质,则加入的物质可以是________或________;
②若只加入0.06 mol某物质,则加入的物质可以是________、________或________。
(4)常温下,同浓度的碳酸钠溶液和碳酸氢钠溶液的pH
都大于7,二者中________的pH更大,理由是________________________;0.1 mol·L-1碳酸钠溶液中离子浓度的大小关系是________;向碳酸氢钠溶液中逐滴滴入氢氧化钡溶液,发生反应的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| | 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。查看答案和解析>>
科目: 来源: 题型:填空题
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,
并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+ )≈________mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是________。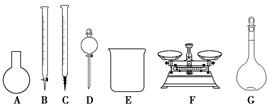
| A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量的NaClO固体质量为143 g |
查看答案和解析>>
科目: 来源: 题型:填空题
Ⅰ.按要求填空(每空1分)
①KOH的电子式: ②NH4Cl的电子式:
③CO2的结构式: ④HClO的结构式:
Ⅱ.按要求填空(每空2分)
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa(25℃时)时,已知0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312 KJ的热量。N2H4完全燃烧反应的热化学方程式是 ;又已知H2O(l)==H2O(g);△H = +44kJ?mol-1,由64g液态肼与氧气反应生成液态水时放出的热量是 kJ。
查看答案和解析>>
科目: 来源: 题型:填空题
将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2 L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
①根据以上数据,用代数式表示CO2的体积V(CO2)= 。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤: 。c(NaOH)= 。
查看答案和解析>>
科目: 来源: 题型:填空题
元素A的单质能与H2化合生成HxA,在标准状况下8.5gHxA气体的体积是5.6L。含5.1g的HxA的溶液与200ml0.75mol/l的CuCl2溶液正好发生复分解反应,并生成黑色沉淀和一种强酸,则:
(1)A 元素的相对原子质量 ,若A 的质子数等于中子数,则A是 元素(填名称)。
(2)A的最高价氧化物是 (填化学式)。这一氧化物在室温下呈 态,将其熔化需要克服 。
(3)HxA与CuCl2溶液反应的离子方程式 。
(4)A的单质在常温下是固体,在常温常压下0.25mol该单质完全燃烧放出QkJ的热量。写出该反应的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com