
科目: 来源: 题型:填空题
在120℃、101 kPa条件下,由H2、CH4、CO组成的混合气体a mL,通入一定量(设为x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧消耗相同条件下氧气的体积也为a mL,(即x=a),则原混合气体中CH4的体积分数是 ;
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是 ,现要测定原混合气体中H2的体积分数,还必须知道相同条件下的其他数据,可以是 (填选项字母);
A.2a mL混合气体的密度
B.生成CO2气体的总体积
C.生成H2O(g)的总质量
(3)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),则x的取值范围是 。
查看答案和解析>>
科目: 来源: 题型:填空题
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 。若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为 。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为 ,混合气体的平均相对分子质量为 。
查看答案和解析>>
科目: 来源: 题型:填空题
(1)2 mol O3与3 mol O2的质量之比 ,分子数之比 ,同温同压下的密度之比 ,含氧原子数之比 ,体积之比 。
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10 L O3与 L Cl2的消毒能力相当。
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为 ,推断的依据为 。
查看答案和解析>>
科目: 来源: 题型:填空题
单质硅是很重要的工业产品。
(1)硅用于冶炼镁,也称硅热法炼镁。根据下列条件:
Mg(s)+ 1/2O2(g)= MgO(s) △H1=-601.8 kJ/mol
Mg(s)= Mg(g) △H2=+75 kJ/mol
Si(s) + O2(g) = SiO2(s) △H3= -859.4 kJ/mol
则2MgO(s)+ Si(s)= SiO2(s)+ 2Mg(g) △H =
Mg-NiOOH水激活电池是鱼雷的常用电池,电池总反应是:Mg+2NiOOH+2H2O=Mg(OH)2+ 2Ni(OH)2,写出电池正极的电极反应式 。
(2)制备多晶硅(硅单质的一种)的副产物主要是SiCl4,SiCl4对环境污染很大,遇水强烈水解,放出大量的热。研究人员利用SiCl4和钡矿粉(主要成分为BaCO3,且含有Fe3+、Mg2+等离子)制备BaCl2·2H2O和SiO2等物质。工艺流程如下:
已知: 25℃ Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mg(OH)2]=1.8×10-11;通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。回答下列问题:
①SiCl4发生水解反应的化学方程式为_______________________________________。
②若加钡矿粉调节pH=3时,溶液中c(Fe3+)= 。
③若用10吨含78% BaCO3的钡矿粉,最终得到8.4吨BaCl2·2H2O (M=244g/mol),则产率为 。
④滤渣C能分别溶于浓度均为3mol/L的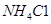 溶液和
溶液和 溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的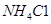 溶液的原因______。
溶液的原因______。
查看答案和解析>>
科目: 来源: 题型:填空题
将一支盛有a mL NO 和b mL NO2气体的试管倒立于水槽中,然后通过a mL O2,请回答以下小题:
(1)若a=b,则充分反应后试管内气体体积为_________mL。
(2)若a<b,则充分反应后试管内气体体积为_________mL。
(3)若a>b,则充分反应后试管内气体体积为_________mL。
查看答案和解析>>
科目: 来源: 题型:填空题
今欲用Na2CO3固体配制500mL 0.02mol/L的Na2CO3溶液。根据题意填空:
(1)配制该溶液应选用 mL容量瓶。
(2)用托盘天平称取 g固体Na2CO3。
(3)将称好的Na2CO3固体放至500mL的大烧杯中,倒入约200mL蒸馏水,用 搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
(4)用少量蒸馏水洗涤烧杯 次,并将每次洗涤的溶液都注入容量瓶, 轻轻晃动容量瓶,使溶液混和均匀。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约 厘米时,改用 滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。
(6)配制好的溶液 (填“能”或“不能”)长期存放在容量瓶中。
查看答案和解析>>
科目: 来源: 题型:填空题
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。
在注射器A中装有240 mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32 g,实验后B管重20.00 g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g。根据实验时温度和压强计算1 mol X气体的体积是24 000 mL,则X的摩尔质量是________。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
近几年地球发生地震灾害较多,抢救地震后被困在废墟下的伤员,首要的措施是给伤员补充能量。下图是医院给伤员输液时用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列的内容后填写:
(1)葡萄糖的摩尔质量为________;
(2)该溶液中含水________g;
(3)该溶液的密度约为________g/mL;
(4)该溶液的物质的量浓度为________mol/L(精确到小数点后面两位)。
查看答案和解析>>
科目: 来源: 题型:填空题
根据下列各题所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量
浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有N个OH-,则可求出此溶液中______________________为__________________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中________为________。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中__________为________。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得到白色固体b g,则可求出原氯化铝溶液中________为________。
查看答案和解析>>
科目: 来源: 题型:填空题
根据下面物质间转化的框图,回答有关问题;
`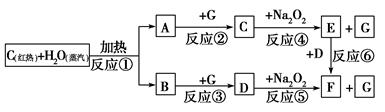
(1)由反应①产生的A、B混合物的工业名称是________。
(2)写出框图中D、E的化学式:D________;E________。
(3)如果2 mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是________L,同时反应中转移电子总数是____________。(NA表示阿伏加德罗常数)
(4)如果A、B混合气体7.8 g,在与G充分反应后,通过足量Na2O2层,可使Na2O2增重________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com