
科目: 来源: 题型:填空题
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
查看答案和解析>>
科目: 来源: 题型:填空题
三氯化铁是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为
b g·mL-1,则该盐酸的物质的量的浓度是________。
向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为 ________。
(3)FeCl3溶液可以用来净水,其净水的原理为____________________ _____________________(用离子方程式表示),若100mL 2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________0.2NA(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目: 来源: 题型:填空题
(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是________。
(2)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为________。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为________。
(3)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为________,混合气体的平均相对分子质量为________。
(4)现有m g某气体,它的摩尔质量为M g·mol-1,则
①该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为________。
②该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:填空题
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠钾合金可在核反应堆中用作热交换液。5.05 g钠钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
_____________________________________________________________
②计算并确定该钠钾合金的化学式。
_____________________________________________________________
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
已知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
_________________________________________________________________
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| | 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目: 来源: 题型:填空题
某校化学小组学生进行“气体相对分子质量的测定”的实验。操作如下:用质量和容积都相等的烧瓶收集气体,称量收集满气体的烧瓶质量,数据见下表(已换算成标准状况下的数值)。
| 气体 | 烧瓶和气体的总质量(g) |
| A | 48.4082 |
| B | 48.4082 |
| C | 48.4082 |
| D | 48.4342 |
| E | 48.8762 |
查看答案和解析>>
科目: 来源: 题型:填空题
“氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。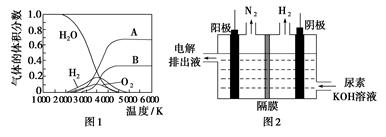
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:填空题
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下: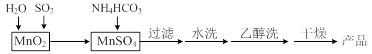
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、 。
⑵①检验水洗是否合格的方法是 。
②水洗结束后,用乙醇洗涤的目的是 。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
查看答案和解析>>
科目: 来源: 题型:填空题
制备Cl2需用8mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
(1)需要用量筒量取12 mol·L-1的盐酸的体积为 mL;
(2)实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号) 。
A.100mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
G.100mL烧杯 H.100mL容量瓶
(3)下列实验操作中,不正确的是 (填写标号)。
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2 cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目: 来源: 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: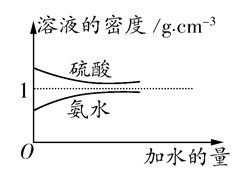
| | 溶质的物质的量 浓度(mol·L-1) | 溶液的密度(g·cm-3) |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
 c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度
c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度 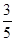 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。查看答案和解析>>
科目: 来源: 题型:填空题
将24.4 gNaOH固体溶于水配成100 mL溶液,其密度为1.219 g/mL。
(1)该溶液中NaOH的物质的量浓度为 。
(2)该溶液中NaOH的质量分数为 。
(3)从该溶液中取出10 mL,其中NaOH的物质的量浓度为 ,NaOH的质量分数为 ,溶液的密度为 ,含NaOH的质量为 ,含NaOH的物质的量为 。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com