
科目: 来源: 题型:填空题
物质的量是高中化学中常用的物理量,请完成以下有关其内容的计算。
(1)0.2 g H2含有个______H原子。
(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为______。
(3)100 mL 某Al2(SO4)3溶液中,n(Al3+)="0.20" mol,则其中c(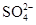 )= ______mol/L。
)= ______mol/L。
(4)在9.5 g某二价金属的氯化物中含0.2 mol Cl-,此氯化物的摩尔质量为______;该金属元素的相对原子质量为______。
(5)标准状况下6.72 L CO与一定量的 Fe2O3恰好完全反应(生成Fe和CO2)后,剩余固体的质量为______g。
查看答案和解析>>
科目: 来源: 题型:填空题
向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示: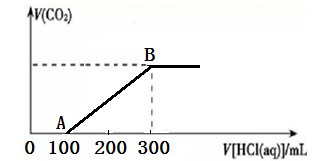
(1)OA段、AB段发生反应的离子方程式__________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是______________。
查看答案和解析>>
科目: 来源: 题型:填空题
按要求完成下列问题:
(1)0.5 mol H2O的质量为 g,共有____________个分子。
(2) 0.01mol某物质的质量为1.08g,则此物质的摩尔质量为__________________。
(3)配制50 mL 0.2 mol·L—1 CuSO4溶液,需要CuSO4_____________g。
查看答案和解析>>
科目: 来源: 题型:填空题
Ⅰ.实验室配制1mol/L Na2CO3溶液250ml。
(1)需要固体Na2CO3 g;(2)该溶液中的阳离子数目为 个;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液 ml;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为 L。
(5)配制该溶液的操作顺序是(用字母表示,不重复使用) 。
| A.称量 | B.洗涤 | C.定容 | D.溶解 E.摇匀 F.转移 |
查看答案和解析>>
科目: 来源: 题型:填空题
按要求回答下列问题。
(1)SO2是形成酸雨的罪魁祸首。 64 g SO2的物质的量为 ,在标准状况下的体积约为 ,所含原子数为 。
(2)写出除去下列物质所含杂质(括号内为杂质)所用的试剂或方法:
①Na2CO3固体(NaHCO3) ②FeCl3溶液(FeCl2)
③Mg粉(Al) ④CO2(SO2)
查看答案和解析>>
科目: 来源: 题型:填空题
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol?L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol?L-1的稀盐酸。
①容量瓶上需标有以下五项中的 。
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②将下列操作填写完整,并排列其正确的操作顺序 (字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取浓盐酸 mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀
C.将已冷却的盐酸沿玻璃杯注入 中
D.将容量瓶盖紧,颠倒摇匀
E.改用 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面至刻度线下 处。
查看答案和解析>>
科目: 来源: 题型:填空题
闪锌矿(主要成份为ZnS)是含锌主要矿物之一,空气中高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。回答下列问题(以下计算保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留
固体的质量为1.32 g,样品中含硫化锌的质量分数是_________。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(反应中只生成一种还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液中和余酸,耗用NaOH溶液的体积为21.70 mL。
①反应后溶液中多余的硫酸是____________ mol。
②通过计算确定浓硫酸被还原的产物是________________________。
(3)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量。
查看答案和解析>>
科目: 来源: 题型:填空题
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)__________________________________________________。
(2)实验室中还可以采用如图装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O  NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图,装置B中盛装的干燥剂是________。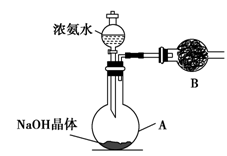
②该同学利用图装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:____________________________________________________。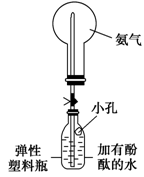
查看答案和解析>>
科目: 来源: 题型:填空题
明矾石的主要成分为K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。某校研究小组利用明矾石制备氢氧化铝的流程如下:
(1)“焙烧”过程中反应的化学方程式为 Al2(SO4)3+
Al2(SO4)3+ S
S
 Al2O3+
Al2O3+ ______↑。
______↑。
(2)分离溶液和废渣的操作是________,“溶解”时反应的离子方程式为_________________________________________________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是________。
(4)“母液”中可回收的物质是________。
(5)若“焙烧”过程中恰好消耗48 g硫黄,则理论上最终可得到________ g氢氧化铝。
查看答案和解析>>
科目: 来源: 题型:填空题
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。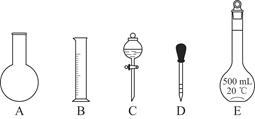
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。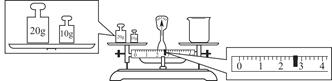
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com