
科目: 来源: 题型:填空题
(14分)Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
查看答案和解析>>
科目: 来源: 题型:填空题
(8分)含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)写出硫元素在周期表中位置______________
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式 。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。该反应的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:填空题
(16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: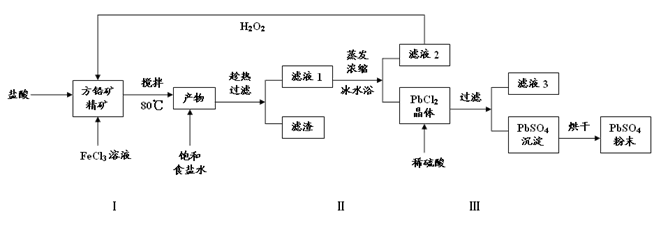
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0
PbCl4-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的 PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:填空题
(10分) A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②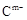 、
、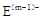 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
HmDm的电子式___________________。(1分)
能证明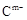 、
、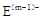 的还原性强弱的离子方程式为__________________________________。
的还原性强弱的离子方程式为__________________________________。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:__________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式 。
在该溶液中溶质中含有的化学键类型是 (1分)
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。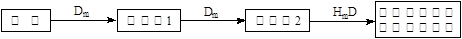
查看答案和解析>>
科目: 来源: 题型:填空题
(10分)甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示;
④取少量甲溶液于试管中,加入过量NaOH溶液并加热;
回答下列问题:
(1) D在周期表中的位置 写出化合物AB3的电子式
(2)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比1:1,且1 mol 甲晶体中含有12 mol结晶水。则甲晶体的化学式为 。
(3)实验③中根据图像得V(Oa):V(ab):V(bc)= 。
(4)实验④中离子方程式是 。
查看答案和解析>>
科目: 来源: 题型:填空题
(8分)有一瓶澄清的溶液,其中可能含有NH4+、K+、 Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2- 。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 离子的存在。
(2)由②可以证明 离子的存在,同时排除 离子存在。理由是_________________________。
(3)由③可证明 离子存在。
(4)由④可以排除 离子存在,同时证明 离子的存在。
查看答案和解析>>
科目: 来源: 题型:填空题
(11分)含有下列离子的五种溶液①Ag+②Mg2+③Fe2+④Al3+⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是____________(填离子符号,下同)
(2)向③中加入NaOH溶液,现象是 有关反应的离子方程式或化学方程式为 。
(3)加入过量NaOH溶液无沉淀的是_____________
(4)加铁粉溶液质量增重的是_________,溶液质量减轻的___________
(5)遇KSCN溶液呈红色的是_________________________
(6)能用来鉴别Cl–存在的离子是___________
查看答案和解析>>
科目: 来源: 题型:填空题
(6分)完成下列反应的离子方程式:
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42—恰好完全沉淀:
(2)向明矾溶液中逐滴加入Ba(OH)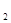 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时:
(3)向Ca(HCO3) 2溶液中加入过量的NaOH溶液:
查看答案和解析>>
科目: 来源: 题型:填空题
(10分)已知反应:3NO2+H2O==2HNO3+NO,回答下列问题:
(1)该反应的离子方程式为 。
(2)氧化剂与还原剂的质量比为 ,氧化产物与还原产物的物质的量之比为 。
(3)在标准状况下,3.36L NO2与H2O完全反应转移的电子数目为 。
(4)写出HNO3与石灰水反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:填空题
(10分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7 + H2SO4(稀) CO2↑+ Cr2 (SO4) 3+ + .
CO2↑+ Cr2 (SO4) 3+ + .
(1)此反应的氧化剂是 ,被氧化的元素是 。
(2)完成并配平上述反应的化学方程式。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com