
科目: 来源: 题型:填空题
(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | CO32—、SiO32—、AlO2—、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
 Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。查看答案和解析>>
科目: 来源: 题型:填空题
Ⅰ.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为 。
其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O 2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
,正极附近溶液的pH (填“变大”、“不变”或“变小”)。
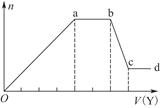
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。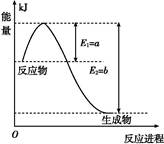
(1)如图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 |
| C.使用催化剂 | D.降低温度 |
 6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。查看答案和解析>>
科目: 来源: 题型:填空题
综合利用转炉煤气[CO(60~80%)、CO2(15~20%)及微量N2等]和硫酸工业尾气中的SO2,既能净化尾气,又能获得保险粉(Na2S2O4),其部分工艺流程如下: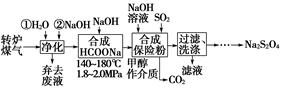
(1)转炉炼钢时,存在反应:Fe3C(s)+CO2(g)??2CO(g)+3Fe(s),其平衡常数表达式为K=________。
(2)煤气净化时,先用水洗再用NaOH溶液洗涤,其目的是________。
(3)从滤液中回收甲醇的操作方法是____________________________;
还可回收的盐类物质是______________________________________(只写一种化学式)。
(4)合成保险粉反应的化学方程式为_________________________。
(5)保险粉、H2O2均可用于纸浆漂白,写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
某厂废水中含5.00×10-3 mol·L-1的Cr2O,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程: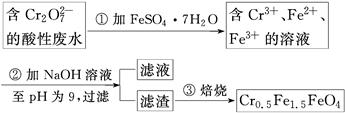
(1)第①步反应的离子方程式是________________________________________________。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有__________。
(3)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________g FeSO4·7H2O。
查看答案和解析>>
科目: 来源: 题型:填空题
化合物A、B是中学常见的物质,其阴阳离子可从下表中选择
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+ |
| 阴离子 | OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
查看答案和解析>>
科目: 来源: 题型:填空题
在灾后重建中,饮用水安全占有极为重要的地位,某研究小组提取三处被污染的水源进行分析,并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42—、HCO3—、NO3—、OH- |
查看答案和解析>>
科目: 来源: 题型:填空题
正三价铁元素有一定的氧化性,FeCl3溶液吸收一定量SO2后溶液颜色发生变化。
(1)反应的离子方程式为_________________________________________________。
(2)除H+,OH-,H2O外,溶液中一定含有的微粒有________。
| A.Fe2+ | B.Fe3+ | C.Cl- | D.SO42— E.H2SO3 |
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
查看答案和解析>>
科目: 来源: 题型:填空题
1 L某混合溶液,可能含有的离子如下表。
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
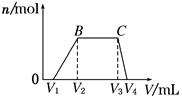
| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目: 来源: 题型:填空题
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC[Al2(OH)nCl6-n]的流程如下: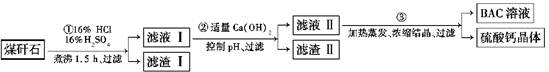
(1)粉碎煤矸石的目的是__________________________________________________;
滤渣Ⅰ的主要成分是________(填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中的有色离子为_____
________(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为_________;步骤①的煮沸装置上方需安装一长导管,长导管的作用是__________________________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是________
_______________________;已知BAC的分散质粒子大小在1~100 nm之间,由此区别滤液Ⅰ与BAC两种液体的物理方法是________________________;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式:_______________________
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式:____________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
已知 0.4 mol 液态肼和足量H2O2反应生成氮气和水蒸气时放出256.64 kJ的热量。
(1)写出肼和H2O2反应的热化学方程式: 。
(2)已知H2O(l)=H2O(g) ΔH="+44" kJ/mol,则16 g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 。
(3)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 。
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: ,该反应的还原产物是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com