
科目: 来源: 题型:填空题
有以下物质:①液氨;②氨水;③盐酸;④醋酸;⑤硫酸钡;⑥银;⑦氯化钠晶体;⑧二氧化碳;⑨醋酸铵;⑩酒精溶液。
(1)属于电解质的是_____________________________________________________________;
(2)能导电的是_________________________________________________________________;
(3)属于强电解质的是___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________(填编号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)一种无色透明溶液中,可能含有下列离子: 、
、 、I-和Cl-,取该溶液进行如下实验:
、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2溶液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀硝酸的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是_______;肯定存在的离子是_______;不能作出判断的离子是_______。
查看答案和解析>>
科目: 来源: 题型:填空题
1 L 某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、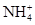 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、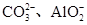 |

| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目: 来源: 题型:填空题
食盐和工业用盐具有广泛的用途。已知工业用盐主要成分为NaNO2,外观酷似食盐并有咸味。NaNO2有氧化性和还原性,遇酸分解放出NO2。
(1)下列试剂可鉴别工业用盐和食盐的是________。
a.H2O b.硝酸酸化的硝酸银 c.盐酸
(2)NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为______________。
(3)某工厂废液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2中的氮转化为对空气无污染的气体,该物质是________。
a.NaCl b.NH4Cl c.浓H2SO4
(4)氯碱工业通过电解饱和食盐水来获得相应的产物。请写出电解食盐水的离子方程式______________________________________,
若在标准状况下生成3.36 L H2,则溶液中生成的OH-的物质的量为____。
查看答案和解析>>
科目: 来源: 题型:填空题
某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出离子方程式:
实验①:______________________________________________________;
实验②:______________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
| A.Br2>I2 | B.Fe3+>Br2 | C.Br2>Fe3+ | D.I->Br- |
查看答案和解析>>
科目: 来源: 题型:填空题
现有五种可溶性物质A、B、C、D、E,它们所含阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3—、CO32—、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为________。
A.SO32— B.SO42— C.CH3COO- D.SiO32—
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的________(填相应的离子符号)。有关反应的离子方程式为___________________。
(4)利用上述已经确定的物质,可以检验出D、E中的阳离子,请简述实验操作步骤、现象及结论:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
铜单质及其化合物是应用极其广泛的物质。
(1)铜是氢后金属,不能与盐酸发生置换反应,但将单质铜置于浓氢碘酸中,会有可燃性气体及白色沉淀生成,又知氧化性:Cu2+>I2,则铜与氢碘酸反应的化学方程式为____________________________________________________。
(2)已知Cu2O能溶于醋酸溶液或盐酸中,同时得到蓝色溶液和红色固体,则Cu2O与稀硫酸反应的离子方程式为____________________________________;
Cu2O与稀硝酸反应的离子方程式为_____________________________;
只用稀硫酸来确定某红色固体是 Cu2O与Cu组成的混合物的方法:称取m g该红色固体置于足量稀硫酸中,充分反应后过滤,然后___________________。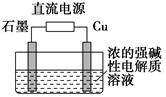
(3)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解装置如图所示,电解总反应:2Cu+H2O电解,Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
(4)现向Cu、Cu2O、CuO组成的混合物中加入1 L 0.6 mol/L HNO3恰好使混合物溶解,同时收集到2 240 mL NO(标准状况)。若将上述混合物用足量的氢气还原,所得固体的质量为________;若混合物中含有0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗硫酸的物质的量为________。
查看答案和解析>>
科目: 来源: 题型:填空题
(1)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生如下离子反应(未配平):
Mn2++S2O82—+H2O→MnO4—+SO42—+H+;
①该反应常用于检验Mn2+的存在,其特征现象是___________________________________。
②若反应中有0.1 mol还原剂参加反应,则转移电子数为________NA,消耗氧化剂的物质的量______________mol。
③写出该反应的离子方程式_________________________________。
(2)①向CuSO4溶液中通入硫化氢生成黑色沉淀CuS的离子方程式为___________________________________;
②向FeCl3溶液中加入过量的碘化钠溶液的离子方程式为_____________。
(3)在碱性介质中,H2O2有较强的还原性,可与Ag2O反应,该反应中氧化剂与还原剂的物质的量之比为___________________。
(4)为测定大气中的臭氧(O3)含量,将0℃、1.01×105 Pa的空气V L慢慢通入足量KI溶液,使臭氧完全反应;然后将所得溶液用a mL c mol·L-1的Na2S2O3溶液进行滴定,恰好达到终点。已知:2Na2S2O3+I2=Na2S4O6+2NaI。
①该滴定过程中可选择的指示剂为________。
②O3与KI溶液反应生成两种单质,则反应的化学方程式为___________________________。
③空气中臭氧的体积分数为________(用含“a、c、V”的字母表示)。
查看答案和解析>>
科目: 来源: 题型:填空题
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32— NO3— SO42— SiO32— I- |
查看答案和解析>>
科目: 来源: 题型:填空题
高锰酸钾在实验室和工农业生产中有广泛的用途.实验室以二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
(1)第①步加热熔融应在 中进行.而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通入CO2,可以使Mn片发生反应.生成MnO4—和MnO2。反应的离子方程式为 。则完成反应时,转化为KMnO4的占全部K2MnO4的百分率约为 (精确到0.1%)。
(3)第⑤步趁热过滤的是 。
(4)第⑥步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、 、洗涤、干燥。干燥过程中.温度不宜过高.其原因是 (用化学方程式表示)。
(5)H2O2和KMnO4,都是常用的强氧化剂。若向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色.写出该反应的离子方程式: .该反应说明H2O2的氧化性比KMnO4 (填“强”或“弱”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com