
科目: 来源: 题型:计算题
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3 g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。
另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)试通过计算确定该结晶水合物的化学式为 ;
(2)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0 mol·L-1。
①加入少量Ba(OH)2溶液,则反应的离子方程式为 ;
②加入一定量的Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为 ;
③若加入75 mL的Ba(OH)2溶液,则得到的沉淀质量为 。
查看答案和解析>>
科目: 来源: 题型:计算题
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2DZ Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式:_____________________。萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是___________________________。
(2)如图是用双硫腙(HzDz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~ CCl4络合萃取法处理废水。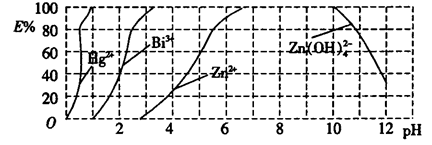
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH=________。
②当调节pH=2时,铋(Bi)的存在形式有_________________。
(3)污水中的亚汞离子(Hg2+ 2)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化(Hg2+ 2),写出该反应的化学方程式:________________________。
查看答案和解析>>
科目: 来源: 题型:计算题
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaC1O;氯气与热的氢氧化钠溶液反应可生成NaC1O和NaC1O3。②在酸性较弱时KI只能被NaC1O氧化,在酸性较强时亦能被NaC1O3氧化。
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为 (填“阳极”或“阴极”)。生成NaClO的离子方程式为 。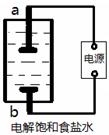
(2)该小组将0.784 L(标准状况)Cl2通入50.00 mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0 mL。
①取稀释后的溶液25.00 mL用醋酸酸化,加入过量KI溶液。用0.2000 mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00 mL时恰好到达终点。
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00 mL。
①操作②中氯酸钠与碘化钾反应的离子方程式为 。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为 。
③计算氢氧化钠溶液的物质的量浓度。
查看答案和解析>>
科目: 来源: 题型:计算题
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目: 来源: 题型:问答题
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。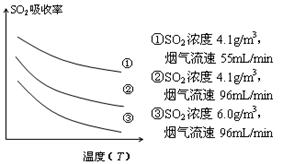
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。

A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目: 来源: 题型:问答题
雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是 。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示: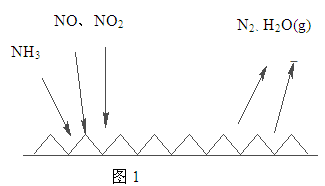

①由图1可知SCR技术中的氧化剂为 。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)= 。当NO2与NO的物质的量之比为1:1时,用氨脱氮,每生成1molN2放出的热量为QkJ,写出该反应的热化学方程式 。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会 (填“升高” 、“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
(4)碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是_________ 。
查看答案和解析>>
科目: 来源: 题型:问答题
(14分)已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。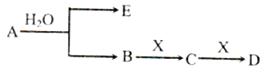
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量, 产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。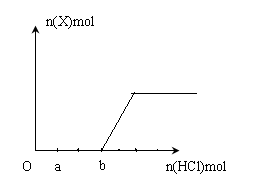
请回答:a点溶液中所含溶质的化学式为__________ ,b点溶液中各离子浓度由大到小的关系是_________________________________。
查看答案和解析>>
科目: 来源: 题型:问答题
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列个问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称)
(2)催化氧化阶段反应2SO2(g)+O2(g)  2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。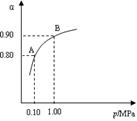
理论上要提高SO2的转化率,反应的条件应是 温 、高压(填“高”、“低”、或“常” ),但通常情况下工业生产中采用常压的原因是 。
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。该反应的平衡常数等于 。
(3)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。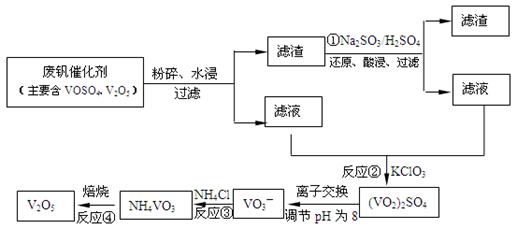
则:反应①②③④中属于氧化还原反应的是 (填数字序号),反应③的离子方程式为 。该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。 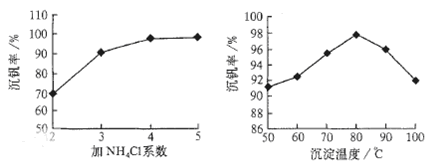
查看答案和解析>>
科目: 来源: 题型:填空题
目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是 。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下: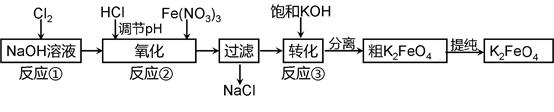
①写出反应①的离子方程式 。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。
(4)FeO42—在水溶液中的存在形态图如图所示。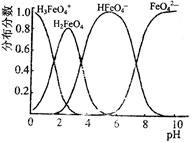
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是 。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中, 转化为 (填化学式)。
查看答案和解析>>
科目: 来源: 题型:填空题
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1。
由②可知存在的离子为 ,浓度是 mol·L-1。
由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com