
科目: 来源: 题型:填空题
(8分)钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。
完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向_____________________。
(3)在20.00mL的0.1mol/L VO2+溶液中,加入 0.195g锌粉,恰好完成反应,则还原产物可能是__________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+____________。
查看答案和解析>>
科目: 来源: 题型:填空题
(12分)某工业废水肿含有一定量的Cr2O72-和CrO42-,现
取样该工业废水,检测其中铬的含量。
步骤I:取25. 00 mL废水,加入适后稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,滴人几滴指示剂。
步骤Ⅲ: 用o .1000 mol·L-1Na2S2O3溶液滴定(I2+2Na2 S2O3= 2NaI+Na2S4O6)
达到终点时消耗溶液24. 00 mL。
步骤Ⅳ:将上述反应后的溶液进行如下处理:反应后废液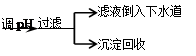
回答下列问题
(1)步骤I加入稀硫酸酸化的目的是 ;
(2)步骤Ⅱ中发生如下反应,请完善并配平离子方程式
该步骤中所加指示剂是 ;
(3)步骤Ⅲ判断滴定达到终点的现象是__ __。
(4)步骤Ⅳ在生产生活中的意义是____ (任答一条);
(5)计算工业废水中铬元素的含量是 mg/L.
查看答案和解析>>
科目: 来源: 题型:填空题
已知BrFn与水按3:5物质的量比反应,生成HF、HBrO3、O2和Br2,且O2和Br2物质的量相等.请回答:
(1)n= (2)氧化产物是 (3)1mol水可还原 mol BrFn?
查看答案和解析>>
科目: 来源: 题型:填空题
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+__________。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O +I2===S4O
+I2===S4O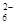 +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示: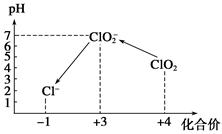
请回答:
①操作Ⅰ中反应的离子方程式是______________________________。
②确定操作Ⅱ完全反应的现象是______________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目: 来源: 题型:填空题
(6分)1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL。
查看答案和解析>>
科目: 来源: 题型:填空题
2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)C1O2和C12(还原产物都为Cl一)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,C1O2的消毒效率是C12的 倍。
(2)自来水厂常用高铁酸钠(Na2FeO4,强氧化剂)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理: 。
(3)某无色废水中可能含有Fe3+、A13+、Mg2+、Na+、NO3-、CO32一、SO42-离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如图所示:
请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液80 ml,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为 。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为 。
③试确定NO3-是否存在? (填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-) (若不存在,此问不必作答)。
查看答案和解析>>
科目: 来源: 题型:单选题
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为2:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
| A.1:10 | B.1:8 | C.1:6 | D.1:5 |
查看答案和解析>>
科目: 来源: 题型:单选题
判断下列有关化学基本概念的依据正确的是
| A.胶体:组成物质的直径是否在1nm~100nm之间 |
| B.氧化还原反应:反应前后元素的化合价是否发生了变化 |
| C.共价化合物:组成化合物的元素是否全部都是非金属元素 |
| D.化学变化:是否有热效应、颜色变化、气体或沉淀生成等四种实验现象 |
查看答案和解析>>
科目: 来源: 题型:单选题
下列反应既是氧化还原反应,又是吸热反应的是
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的木炭与CO2反应 | D.甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目: 来源: 题型:单选题
有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种微粒,分别属于同一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A.氧化剂与还原剂的物质的量之比为8:1 |
| B.还原产物为NH+4 |
| C.若有l mol NO-3参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+—e-=Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com