
科目: 来源: 题型:填空题
电镀厂镀铜废水中含有CN-和Cr2O72-,需要处理达标后才能排放。该厂拟定下列流程进行废水处理:
回答下列问题:
(1)上述处理废水流程中主要使用的方法是________。
(2)②中反应后无气体放出,该反应的离子方程式为______________________________
__________________________________。
(3)步骤③中,每处理0.4 mol Cr2O72-时转移电子2.4 mol,该反应的离子方程式为________________________________________________________________________。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因:
________________________________________________________________________。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O,将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列结论正确的是________。
| A.x=0.5,a=8 | B.x=0.5,a=10 |
| C.x=1.5,a=8 | D.x=1.5,a=10 |
查看答案和解析>>
科目: 来源: 题型:填空题
水处理技术在生产、生活中应用广泛。
(1)工业上常用绿矾作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾。请解释这一做法的原因:_______________________________________________________________________。
(用必要的离子方程式和文字做答)
(2)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。①硬水软化的方法通常有________、________和离子交换法。离子交换树脂使用一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,________洗涤效果较好,原因是________________________________________________________________________。
(3)我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是________________________________________。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理。首先在硝化细菌作用下将NH4+氧化为NO3-:________NH4++________O2=________NO3-+________H++______H2O,然后,加入甲醇与NO3-生成N2:______NO3-+______CH3OH=________N2↑+________CO2↑+________H2O+________OH-。
试配平以上两个离子方程式。
查看答案和解析>>
科目: 来源: 题型:填空题
金属冶炼与处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是________。当1 mol O2发生反应时,还原剂所失电子的物质的量为________mol。向CuSO4溶液中加入镁条时有气体生成,该气体是________。
(3)如图为电解精炼银的示意图,________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为__________________________。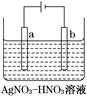
(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用是______________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-??H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)??Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理: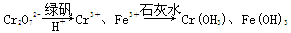
(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目: 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2=2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用__________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________
________________________________________________________________________。
②每生成1 mol FeO42—转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的反应方程式___________________________________________。
(2)已知:Se+2H2SO4(浓)―→2SO2↑+SeO2+2H2O,2SO2+SeO2+2H2O―→Se+2SO42—+4H+,则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3―→Na2S4O6+2NaI。配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:填空题
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) ΔH1=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。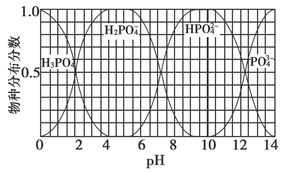
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇(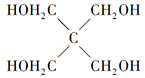 )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示: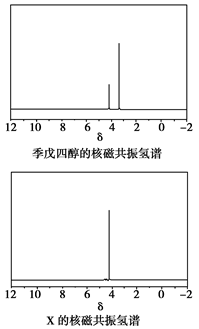
①酸性气体是______________________(填化学式)。
②X的结构简式为__________________。
查看答案和解析>>
科目: 来源: 题型:填空题
Ⅰ.在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
(1)0~4 min的平均反应速率v(CO)=________mol/(L·min),反应在第5 min时的平衡常数K=________。
t℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0. 200 | 0. 300 | 0 | 0 |
| 2 | 0. 138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0. 116 | 0. 216 | 0. 084 | |
| 6 | 0. 096 | 0. 266 | 0. 104 | |
查看答案和解析>>
科目: 来源: 题型:填空题
I.根据反应3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)氧化剂是 , 元素被氧化;
(2)用“双线桥”表示该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,转移的电子数为 ;
II. 有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请将这6种物质组成一个化学方程式(需配平):
2002年9月26日,中国北京曙光公司研制出了第一款具有我国完全自主知识产权的高性能CPU 芯片— “龙芯”1号。该芯片中主要成分可以制成计算机长距离联网传输的线路材料,这种埋在地下的材 料如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因
查看答案和解析>>
科目: 来源: 题型:填空题
I. 今有H2、Cl2混合气100 mL(标况),其中一种气体的体积为45mL。光照使两种气体发生反应后恢复到标况,气体体积为 mL。为了说明反应后气体中H2或Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后恢复到标况,
(1)若仍剩余___mL,证明有___剩余,理由是_____;
(2)若溶液有___性质,证明有___剩余,理由是________________________。
II.一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图所示)。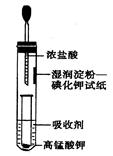
(1)下列溶液能吸收Cl2的是________。
| A.饱和食盐水 | B.Na2SO4溶液 |
| C.NaOH溶液 | D.浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com