
科目: 来源: 题型:填空题
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)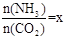 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。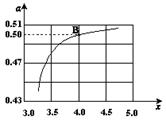
已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→ ――③
(5)反应③中的还原剂是 ,还原产物是 。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是 mol。
查看答案和解析>>
科目: 来源: 题型:填空题
磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为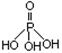 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。
(2)氧原子核外有 种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+ 。请完成并配平上述反应离子方程式。该反应的还原产物是__________。
查看答案和解析>>
科目: 来源: 题型:填空题
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 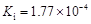 |  | 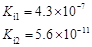 | 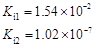 |
 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O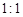 ,试配平上述化学方程式。
,试配平上述化学方程式。查看答案和解析>>
科目: 来源: 题型:填空题
氮元素十分重要,其单质及其化合物在科研、生产领域有着十分广泛的用途。
(1)氮元素核外电子排布式为: ,原子核外共有 种不同能级的电子,氮原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
(2)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化 B.通入大量稀有气体能提高反应的速率
C.容器中气体的密度不随时间而变化 D.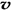 (N2)/
(N2)/ 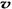 (O2)=2:3
(O2)=2:3
(4)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解,反应的化学方程式4NH4ClO4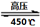 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
查看答案和解析>>
科目: 来源: 题型:填空题
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式 ________________________________________。
(3)n(KBrO3) = 4时,对应含碘物质的化学式为 。
查看答案和解析>>
科目: 来源: 题型:填空题
次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 。
(4)从二个化学镀镍反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾还产生了一种单质气体
查看答案和解析>>
科目: 来源: 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|
 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目: 来源: 题型:填空题
(4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)在该反应中,还原剂是 。
(2)若在反应中生成了标况下2.24L氯气,则电子转移的个数是 NA。
查看答案和解析>>
科目: 来源: 题型:填空题
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)稀释后的溶液pH= ;
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
查看答案和解析>>
科目: 来源: 题型:填空题
实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中氧化剂是_____________,还原剂是__________________。
(2)若反应中有0.20 mol 电子发生转移,生成氯气的体积为 (标准状况),被氧化的HCl的物质的量是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com