
科目: 来源: 题型:填空题
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40 ℃~50 ℃时
反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+ 在酸
性条件下发生的反应是2Cu+ =Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是________________。
(2)写出CuH在氯气中燃烧的化学反应方程式_______________________________。
(3)CuH溶解在稀盐酸中生成的气体是___________,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是________________。
查看答案和解析>>
科目: 来源: 题型:填空题
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ,ΔH=—76.0 kJ·mol-1,该反应中每放出38 kJ热量,转移电子的物质的量为 mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO20.2mol·L—1,H20.8mol·L—1, CH40.8mol·L—1,H2O1.6mol·L—1,起始充CO2和H2的物质的量分别为 、 。CO2的平衡转化率为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充人1 mot CO2,和4 molH2,在II中充人1 mol CH4和2 mol H2 O(g) , 300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |

查看答案和解析>>
科目: 来源: 题型:填空题
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
| A.Na2O2 + 2HCl =" 2NaCl" + H2O2 |
| B.Ag2O + H2O2 =" 2Ag" + O2↑ + H2O |
| C.2H2O2 = 2H2O + O2↑ |
| D.3H2O2 + Cr2(SO4)3 + 10KOH = 2K2CrO4 + 3K2SO4 + 8H2O |

| 实验内容 | 试剂 | 实验现象 |
| 验证氧化性 | | |
查看答案和解析>>
科目: 来源: 题型:填空题
硫、氮、稀土元素的单质和化合物应用广泛。
Ⅰ.(1)将硫铁矿和焦炭放在炼硫炉中,在有限空气中燃烧,发生下列反应:
3FeS2 + 12 C + 8O2 = Fe3O4 + 12CO + 6S
生成3mol硫时,被氧化的物质物质的量为__ _________。
(2)过硫酸钾化学式为:K2S2O8,过硫酸结构式为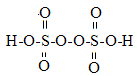
①过硫酸钾和过硫酸均有强氧化性,不稳定,容易分解,如2H2S2O8=2H2SO4+2SO3+O2
下列能加快过硫酸分解的固体物质是 。
| A.CuO | B.MnO2 | C.Fe2O3 | D.NaNO3 |
查看答案和解析>>
科目: 来源: 题型:填空题
(1)配平该反应并标出电子转移的方向和数目:KMnO4+HCl = MnCl2+ KCl+ Cl2↑+ H2O
(2)氧化剂是________________,氧化产物是__________________(填化学式)。
(3)若生成71 g Cl2消耗的HCl是___________________,被氧化的HCl是_______________。
(4)CS2(液体)能在O2中完全燃烧,生成CO2和SO2,若将0.1 mol CS2在1 mol O2中完全燃烧,所得混合气体在标准状况下所占的体积为__________L。
Ⅱ、(6分)(1)下列A. B. C. D 是中学常见的混合物分离或提纯的基本装置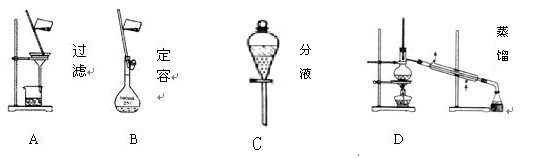
请根据实验需要将A. B.C. D装置填入适当的空格中。
①分离汽油和氯化钠溶液____________________
②用自来水制取蒸馏水__________________
③除去粗盐溶液中悬浮的泥沙_______________________________
(2)检验Fe3+常用的试剂除碱外,还可以将KSCN溶液滴入待检测溶液中,其产生的现象是______
________________________,发生反应的离子方程式________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
铁盐、亚铁盐是实验室常用的药品。根据题意完成下列填空:
(1)若向硫酸亚铁溶液中滴加稀硝酸,可以看到溶液逐渐变黄。为检验最后溶液中是否还有亚铁离子剩余,可以_____________________________________________;向已酸化的FeCl3溶液中逐滴加入Na2S溶液,有浅黄色沉淀生成,溶液逐渐变为浅绿色。写出该反应的离子方程式 。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生。呈红色的物质是 (写化学式)。
已知:11H2O2+2SCN—→2SO42—+2CO2↑+ N2↑+10H2O +2H+若生成1mol N2,H2O2和SCN—的反应中转移电子物质的量是 mol。
(3)由以上实验,推断Fe2+、S2—和SCN—的还原性强弱 (按从强到弱顺序排列)。
(4)向FeCl3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4)。写出此过程的离子方程式、配平并标出电子转移的数目和方向 。
查看答案和解析>>
科目: 来源: 题型:填空题
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
查看答案和解析>>
科目: 来源: 题型:填空题
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
KClO3+ HCl(浓)= KCl+ ClO2+ Cl2+ H2O
(1)配平以上化学方程式(化学计量数填入划线上)并用双线桥标出电子转移的方向和数目。
(2)反应中的氧化剂是 , ClO2是反应的 (填氧化或还原)产物。
(3)反应产生0.1 mol Cl2,则转移的电子的物质的量为 mol。
(4)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位物质的量得到电子数表示)是Cl2的 倍。
查看答案和解析>>
科目: 来源: 题型:填空题
已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)若有71gCl2参加反应,被氧化的物质是 ;转移电子的物质的量为 mol。
(2)反应后,若产生14g N2,则有 g NH3被氧化。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com