
科目: 来源: 题型:填空题
根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 回答下列问题:
(1)氧化剂是 ,氧化产物是 。
(2)氧化剂与氧化产物的物质的量比是 。
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,反应中转移的电子数为 ;
(4)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
将这6种物质分别填入下面对应的横线上,组成一个化学方程式(不需配平):
________+________+________ → ________+________+________
查看答案和解析>>
科目: 来源: 题型:填空题
以下反应①②可用于从不同原料中提取碘:
①2NaI+MnO2+3H2SO4 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3 2Na2SO4+3NaHSO4+H2O+I2
2Na2SO4+3NaHSO4+H2O+I2
(1)反应①中的氧化剂是___________________;反应②中的还原产物是________________。
(2)根据反应①②可推知______。
a.氧化性:IO3->SO42- b.氧化性:MnO2>NaIO3
c.还原性:I->Mn2+ d.还原性:I2>NaHSO3
(3)已知NaI和NaIO3在酸性条件下能反应生成I2 ,写出该反应的离子方程式:
③__________________________________________________________。
(4)三个反应中生成等量的I2时转移的电子数最少的是反应________(填序号)。
查看答案和解析>>
科目: 来源: 题型:填空题
向盛有KI溶液的试管中加入少许CC14后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CC14层会逐渐变浅,最后变成无色。完成下列填空:
(1)上述过程CCl4层在试管中位于 (填上、下)层,分离CC14层和水层的操作名称是____ ,使用的玻璃仪器是 。
(2)写出并配平CC14层由紫色变成无色的化学反应方程式(如果系数是l不用填写);
+ + → HIO3+
(3)把KI换成KBr。则CC14层变为 色,该反应的离子方程式为 。继续滴加氯水,CCl4层的颜色没有变化。Cl2、 HIO3、HBrO3氧化性由强到弱的顺序是 。
查看答案和解析>>
科目: 来源: 题型:填空题
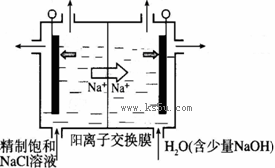
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
科目: 来源: 题型:填空题
请将5种物质:N2O、FeCl2、Fe (NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)_________+__________→__________+__________+__________+H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为___________。
查看答案和解析>>
科目: 来源: 题型:填空题
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+□ =□Fe(OH)3↓+□C1-+□
②检验滤液B中是否还含有铁元素的方法为:
(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
查看答案和解析>>
科目: 来源: 题型:填空题
(1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反应中物质的氧化性:KMnO4_____ Cl2(填“>、<、=”);氧化产物与还原产物的物质的量之比为_____________。
(2)配平下列氧化还原反应方程式:___KMnO4+___H2S+__H2SO4(稀) —— __K2SO4+__MnSO4+__S↓+__H2O
(3)Cl2是一种黄绿色有毒气体,化工厂可用浓氨水来检验有毒气体Cl2是否泄漏,有关反应的化学方程式为:3Cl2+8NH3=6NH4Cl +N2若反应中NH3消耗6.8 g,则转移电子个数为 。
查看答案和解析>>
科目: 来源: 题型:填空题
通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力。按要求回答下列问题。
(1) 现有下列短周期元素性质的部分数据,其中X数值是表示不同元素的原子在分子内吸引电子的能力大小,若X值越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷一方: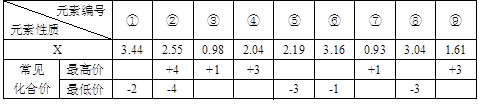
写出下列编号所代表的元素符号:①____,②____,④____,⑤____,⑥____。
(2) 已知4种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为: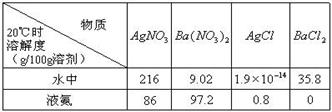
由上表的数据可知,在水溶液中上述化合物发生复分解反应的化学方程式为______________________,在液氨溶液中发生复分解反应的化学方程式为______________________________________________。
(3) 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如右图所示。三种物质和铁发生反应的顺序为___________,第一步反应的离子方程式为________,由图可知溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为__________。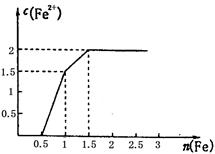
查看答案和解析>>
科目: 来源: 题型:填空题
氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:
(1) 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,此反应中B元素的化合价没有发生变化,则NaBH4中H的化合价为___________,该反应氧化产物是______________,还原产物是______________。
(2) 有下列三个反应:
①Cl2+FeI2=FeCl2+I2 ;②2Fe2++Br2=2Fe3++2Br-;③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
①根据以上方程式可以得到Fe2+、Co2+、Br-、I-还原性由强的弱的顺序为_________;
②1molCo2O3能氧化HCl的物质的量_____________。
(3) 完成并配平下列化学反应方程式:
□KMnO4+□H2C2O4+□________ □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
(4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2H+ +Zn=Zn2++H2↑,可拆写为氧化反应式:Zn-2e-=Zn 2+,还原反应式:2H++ 2e-=H2↑。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
①将2Fe3++Cu= 2Fe2+ +Cu2+拆写为两个“半反应式”:其中,氧化反应式为 。
②由①中的反应,可设计成如右图所示的原电池: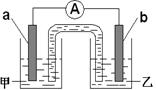
若电极a为Cu ,电解质溶液甲的化学式为 ;
电极b处的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:填空题
已知盐酸参加的下列三个反应:
① CaCO3+2HCl=CaCl2+CO2↑+H2O
② Fe+2HCl=FeCl2+H2↑
③ MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)判断上述三个反应中属于氧化还原反应的是_________,其中盐酸作还原剂的是__________。
(2)上述反应说明盐酸具有_______性,______性,_______性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com