
科目: 来源: 题型:填空题
(16分)某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色。
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的
磁性氧化铁外,还有一种可能原因是 。
② 若要证明反应所得“铁块”中含有金属铝,可用 (填化学式)溶液,所发生反应的离子方程式为 。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H+ + 4I-+ O2 = 2I2 + 2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A—C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 / mL | 出现蓝色时间 /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | | | | | | t |
查看答案和解析>>
科目: 来源: 题型:填空题
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下: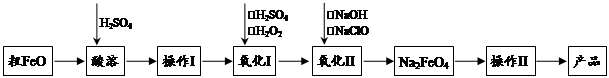
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
①Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
查看答案和解析>>
科目: 来源: 题型:填空题
(12分)某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为较合理的途径及理由是: 。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了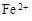 和
和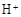 外,还可能存在 (用元素符号表示)。
外,还可能存在 (用元素符号表示)。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是:
、 。
(5)途径④发生反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
查看答案和解析>>
科目: 来源: 题型:填空题
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4?5H2O):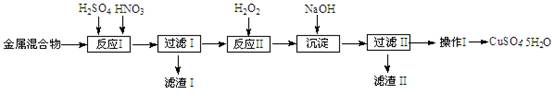
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
 = 2Iˉ+S4O
= 2Iˉ+S4O
查看答案和解析>>
科目: 来源: 题型:填空题
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去)。请按要求回答下列问题:
(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为__________________________。
(2)若A常用作制冷剂,B和D为空气的主要成分,则反应(Ⅲ) 的化学方程式为______________。
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式可以是_________________________。
(4)若D为酸或酸性气体,则A、B、C、D可以是________________(请按顺序写出合理的答案)。
查看答案和解析>>
科目: 来源: 题型:填空题
金属是一种重要的材料,人类的生产和生活离不开金属,下表表示了金属活动顺序表中铜、铁、锡、铝元素被人类大规模开发利用的大致年代。
33. 根据图中数据和有关化学知识,你认为金属大规模开发利用的先后顺序跟______有关(填写编号)。
a. 金属的导热性 b. 金属元素在地壳中的含量
c. 金属的活动性顺序 d. 金属的延展性
34. 钢铁的生产和使用是人类文明和进步的重要标志之一,请用化学方程式表示高炉炼铁的原理___________________________________________。
35. 比较铝、铁的活泼性,可用一个实验事实说明:__________________________________;
但是铝在空气中却表现出很强的抗氧化性,其原因是____________________________。
36. 复方氢氧化铝可以治疗胃酸过多,也能与强碱溶液反应, 写出氢氧化铝的电离方程式___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
(10分) 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。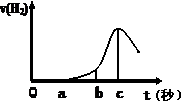
(1)关于图像的描述不正确的是 (填序号,下同);
① o→a段不产生产生H2是室温过低,反应难以发生。
② b → c段产生H2较快可能是反应放热,温度升高,加快了反应
③ c以后,产生H2速率逐渐下降原因可能是铝片趋于消耗完全
(2)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为 mol/(L·s)(假设反应前后溶液体积不变)。
(3)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,合理的有
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L ⑤加CH3COONa固体; ⑥加入少量Na2SO4溶液
(5)催化剂会影响反应速率,请根据①反应写出FeCl3催化H2O2分解的另一反应原理(用离子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;② ;
查看答案和解析>>
科目: 来源: 题型:填空题
(9分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答: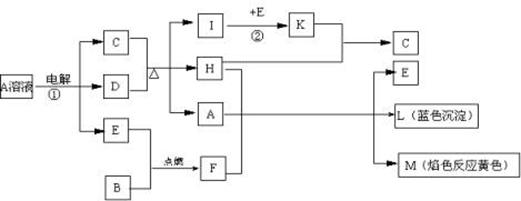
⑴L的化学式: F的电子式: 。
⑵反应①的离子方程式: 。
⑶反应②,工业上采取的反应条件: 。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
。
查看答案和解析>>
科目: 来源: 题型:填空题
(9分)有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白: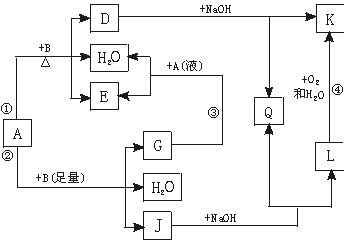
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答):
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com