
科目: 来源: 题型:填空题
(14分)铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下: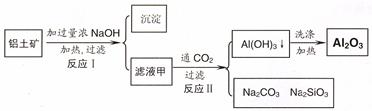
(1)滤液甲的主要成分是(写化学式)
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
A.AlO2― B.OH― C.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为:
(5)取 (4) 电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol? L-1盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL 盐酸溶液发生的离子反应的先后顺序依次为:
②请画出生成沉淀的物质的量与加入盐酸体积的关系图。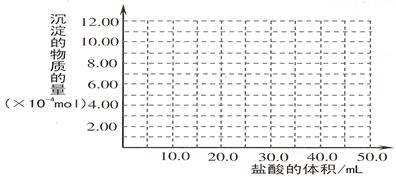
查看答案和解析>>
科目: 来源: 题型:填空题
100毫升含HNO3、H2SO4的稀溶液中,加入9.6克铜充分反应,铜全溶,产生2.24升NO(标准状况)。同体积的混合酸恰好与250毫升2mol/L的NaOH完全中和。
计算原混合酸中HNO3的物质的量浓度的取值范围_________________________
H2SO4的物质的量浓度的取值范围_______________________。
查看答案和解析>>
科目: 来源: 题型:填空题
(10分)如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要的固氮反应。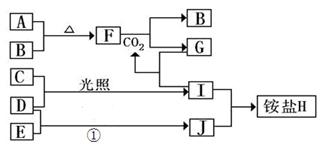
(1)单质E的结构式_____________
(2)F和H2O反应的化学方程式为_____________________________,该反应中被氧化与被还原的物质的物质的量之比是_________________
(3)铵盐H中阳离子的电子式_______________,检验H 中阳离子的方法是____________________
_____________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:填空题
(16分)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b. KClO3 c. MnO2 d. Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
查看答案和解析>>
科目: 来源: 题型:填空题
(12分)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。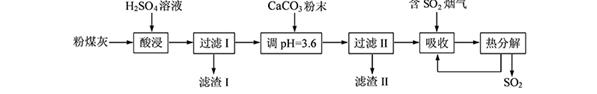
(1)酸浸时反应的化学方程式为 ;滤渣Ⅰ的主要成分为 (填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6—2x。滤渣Ⅱ的主要成分为 (填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是 (用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是 ;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:填空题
(15分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值:)
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目: 来源: 题型:填空题
(8分)
某些化学反应可用下式表示A+B→→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A、C均含有铝元素。①当B是盐酸时,C是 ;
②当B是NaOH时,C是 。
查看答案和解析>>
科目: 来源: 题型:填空题
(8分)将稀硝酸逐滴加入盛有铝铁合金的容器中,当固体恰好完全溶解时,产生标准状况下NO 40.32L,将反应后的溶液平均分成三等份,分别进行如下实验:
(1)第一份溶液中逐滴加入2 mol·L-1NaOH溶液,至恰好达到最大沉淀,不考虑空气中O2的氧化,则需加入NaOH溶液的体积为________________。
(2)第二份溶液中边加入NaOH溶液,边在空气中充分搅拌,至恰好达到最大沉淀量,将产生的沉淀过滤、洗涤、干燥、称量比第一份重5.1g,则该过程中消耗O2的物质的量为_______________。
(3)第三份溶液中逐滴加入4 mol·L-1NaOH溶液,至Al(OH)3沉淀恰好溶解,消耗NaOH溶液500mL,计算原合金中铝的质量。(写出解题过程)(4分)
查看答案和解析>>
科目: 来源: 题型:填空题
(6分)中学化学常见的物质A、B、C、D、E、X有如图所示转化关系。已知A、D是单质,B为氧化物,反应①在高温下发生。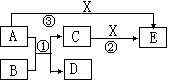
(1)若A、D、X为非金属单质,E是常见的温室气体,则A为____________,X为___________(用化学式填空)。
(2)若A为金属单质,D为非金属单质,X为盐酸,则反应①的化学方程式为________________;反应②的离子方程式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com