
科目: 来源: 题型:填空题
目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下: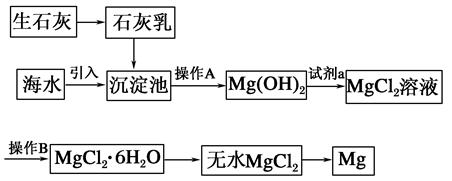
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池中发生反应的离子方程式:_________________________________________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为________,从考虑成本和废物循环利用的角度,副产物氯气可以用于________。
查看答案和解析>>
科目: 来源: 题型:填空题
江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为MgO、Al2O3)工业也较发达。某中学化学探究小组通过查阅相关资料,对蛭石的组成进行了实验探究。
Ⅰ.相关资料:①蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2组成;
②氢氧化物开始沉淀及沉淀完全时的pH:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 |
| 沉淀的pH范围 | 1.5~4.1 | 9.4~12.4 | 3.3~5.2 |

查看答案和解析>>
科目: 来源: 题型:填空题
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被________(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: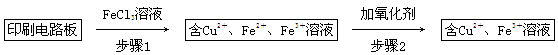

①证明步骤1所加FeCl3溶液过量的方法是_________________________________。
②步骤2中所加的氧化剂最适宜的是______________________________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是________。(写出一种即可)
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) ΔH1=-320 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196 kJ·mol-1
H2(g)+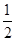 O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的ΔH=________。
(3)欲实现反应Cu+H2SO4=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。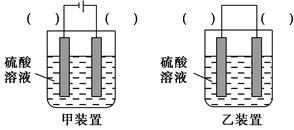
查看答案和解析>>
科目: 来源: 题型:填空题
铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。
上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为
___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
部分铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
________________________________________________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应: _________________________________________;
负极反应:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
科研、生产中常涉及铁及其化合物
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:________________。
查看答案和解析>>
科目: 来源: 题型:填空题
现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,
以下是以硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁αFe2O3)的生产流程示意图: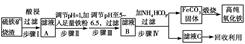
(1)步骤Ⅰ中过滤所得滤渣的主要成分是________。
(2)步骤Ⅱ中加入铁粉的目的是________。
(3)步骤Ⅲ中可选用________调节溶液的pH。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题
如图所示: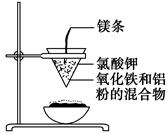
用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:__________,
在该反应中________是氧化剂,________是还原剂,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:________;蒸发皿盛沙:________;镁条:________;氯酸钾:________。
查看答案和解析>>
科目: 来源: 题型:填空题
铁是地壳中含量很丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参与的两个反应的化学方程式:
___________________________。
(2)写出赤铁矿被CO还原成铁的化学方程式:________________。
(3)实验室中可用CO还原Fe2O3,在加热Fe2O3前应________,直到无________现象时才能点燃酒精灯加热,否则可能发生________现象,未反应完全的CO________(填“能”或“不能”)排放到大气中,应做________处理。
查看答案和解析>>
科目: 来源: 题型:填空题
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4、和H2SO4的工艺过程如下所示: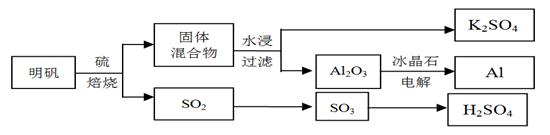
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O + 3S = 2K2SO4 + 2Al2O3 + 9SO2 + 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
(3)Al2O3在一定条件下可制得AlN,其晶体结构如图所示,该晶体中Al的配位数是 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+ O2(g) 2SO3(g) △H1 = -197 kJ /mol;
2SO3(g) △H1 = -197 kJ /mol;
H2O(g) H2O(l) △H2 = -44 kJ/mol;
H2O(l) △H2 = -44 kJ/mol;
2SO2(g)+ O2(g)+ 2H2O(g)=2H2SO4(aq) △H3 = -545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是 。
焙烧948 t明矾(M =" 474" g/mol),若SO2的利用率为96%,可产生质量分数为98%的硫酸 t。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com