
科目: 来源: 题型:填空题
有关物质间转化关系如下图,试回答:
(1)转化①的反应条件为 .
(2)转化②的化学方程式为 .转化③的离子方程式为 .
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择 (填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为 或 mL。
查看答案和解析>>
科目: 来源: 题型:填空题
用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用 (填编号,下同)。
①Cl2 ②H2O2 ③HNO3 ④KMnO4
(2)要得到较纯的产品,试剂B可选用 。
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(3)从滤液经过结晶得到氯化铜的方法是 (按实验先后顺序填编号)。
①过滤 ②冷却 ③蒸发浓缩 ④蒸发至干
(4)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体,加入足量10%的氢氧化钠溶液、过滤、洗涤后用小火加热至质量不再减轻为止,冷却、称量所得固体的质量为n g。
①方案一中灼烧CuCl2·xH2O得到无水CuCl2,应在 (填仪器名称)中进行。
方案二中配制一定量10%的氢氧化钠溶液,其操作步骤是计算、称量、 。
②试评价上述两种实验方案,其中可行的方案是 ,另一种方案不可行的理由是 ,若用方案二,计算得x= (用含m、n的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:填空题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),主要工艺流程如下。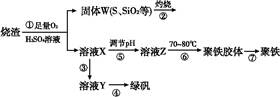
(1)将过程②产生的气体通入下列溶液中,溶液会褪色的是 。
A.品红溶液 B.紫色石蕊试液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS、O2和H2SO4反应的化学方程式为 。
(3)过程③中需加入的物质是 。
(4)过程④中,蒸发结晶时需使用的仪器除酒精灯、三脚架外,还需要 。
(5)过程⑤调节pH可选用下列试剂中的 (填序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是 。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700 0 g样品;②将样品溶于足量的盐酸后,加入过量的BaCl2溶液;③过滤、洗涤、干燥,称重得固体质量为3.495 0 g。若该聚铁的主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
科目: 来源: 题型:填空题
以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下: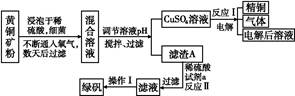
回答下列问题:
(1)下列物质中可以用于上述流程中调节溶液pH的是 (填序号)。
| A.Cu; | B.Cu2(OH)2CO3; | C.H2SO4; | D.Fe;E.CuO |
查看答案和解析>>
科目: 来源: 题型:填空题
某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: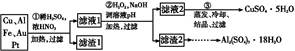
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 ;
调溶液pH的目的是使 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: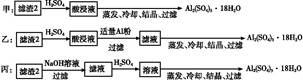
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2- CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目: 来源: 题型:填空题
A~G各物质间的关系如图,其中B、D为气态单质。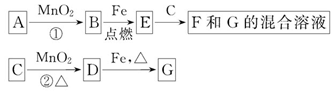
请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_________;若只能在加热情况下进行,则反应物A应为______________;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适的反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。请回答: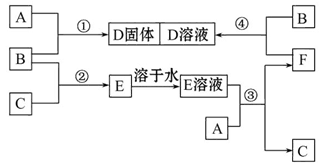
(1)A是_______、B是_______、C是_______ (请填化学式)。
(2)反应①的化学方程式为: ___________________________________。
(3)反应③的离子方程式为: _________________________________________。
(4)反应④的离子方程式为:___________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: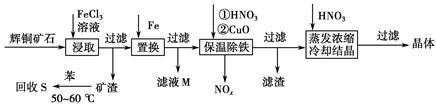
(1)写出浸取过程中Cu2S溶解的离子方程式___________________________。
(2)回收S过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是____________________、____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为______________________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是____________________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是______________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
硝酸铝广泛用于有机合成、印染工业等。工业上以铝灰为原料(主要成分为Al,含少量Al2O3、Fe2O3、SiO2、CaO、MgO等)制备硝酸铝的工艺流程如下:
已知:Al(OH)3沉淀和溶解的pH如下表:
| Al(OH)3 | 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀溶解完全 |
| pH | 3.3 | 5.0 | 7.8 | 12.8 |
查看答案和解析>>
科目: 来源: 题型:填空题
利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下: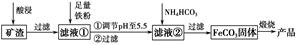
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为______________________________。为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有____________________、____________________。(任举两例)
(2)调节pH至5.5的目的是______________________________________。
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,原因是__________________________________________________。(答一点即可)
(4)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com