
科目: 来源: 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
已知2Na2SiO3+2NaAlO2+2H2O Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 。
(3)固体X的主要成分是 ,过滤时使用的玻璃棒,其作用是 。
(4)滤液B中溶质的主要成分是 (填化学式);滤液E、K中溶质的主要成分是 (填化学式),写出该溶液的一种用途 。
(5)在流程中,选用CO2作酸化剂,为什么不选用盐酸? 。
查看答案和解析>>
科目: 来源: 题型:填空题
如图是测定铝粉(含镁粉)的纯度的实验装置。所用的NaOH(足量)的物质的量浓度为4.5 mol·L-1。不同时间电子天平的读数如下表所示: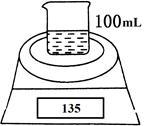
| 实验操作 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 0 | 120 |
| 烧杯+NaOH溶液+样品 | 0 | 135 |
| 1 | 134.5 | |
| 2 | 134.1 | |
| 3 | 133.8 | |
| 4 | 133.8 |
查看答案和解析>>
科目: 来源: 题型:填空题
下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。化合物A是家庭生活中常用的一种调味品,反应①称之为“氯碱工业”。D是黄绿色气体,H的水溶液具有漂白、杀菌性,J为红褐色沉淀。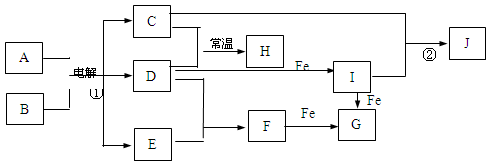
(1)H的化学式为 。
(2)写出I与Fe反应生成G的离子方程式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:填空题
Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的方程式为:
为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用FeSO4晶体配制上述FeSO4溶液时我觉得还需加入 来防止Fe2+被氧化。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)检验Fe3+的最佳试剂是 ,简述其检验方法: 。
查看答案和解析>>
科目: 来源: 题型:填空题
Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。 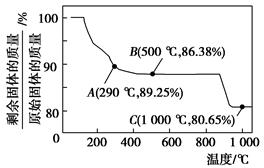
钴的有关性质如下:Co(OH)2具有两性。钴的主要物理、化学参数与铁、镍接近,属铁族元素。
结合以上信息试回答下列问题:
(1)Co(OH)2的制备是在CoCl2溶液中加稍过量的氨水,不用NaOH溶液的原因是________________________________(用化学方程式表示)。制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化,化学方程式为_____________________________________________________。
(2)如图,已知钴的氢氧化物加热至290 ℃时已完全脱水,则1000 ℃时,剩余固体的成分为________________________(填化学式);在290~500 ℃范围内,发生的反应的化学方程式为__________________________________________。
(3)已知常温下,在0.10 mol·L-1 CoCl2溶液中加入氨水充分搅拌,有Co(OH)2沉淀生成,当溶液的pH=8时,c(Co2+)=________mol·L-1(Ksp[Co(OH)2]=1.6×10-15)。常温下反应Co2++2H2O??Co(OH)2+2H+的平衡常数为
_______________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下: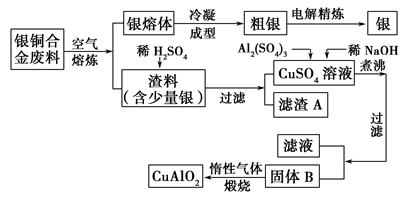
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
科目: 来源: 题型:填空题
某厂的酸性工业废水中含有一定量的Na+、Al3+、 Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。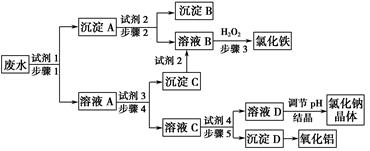
请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为_______________________________________。
(4)步骤3反应的离子方程式为_______________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下: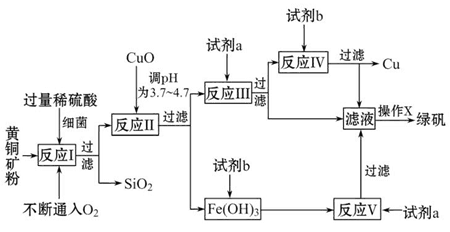
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目: 来源: 题型:填空题
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下: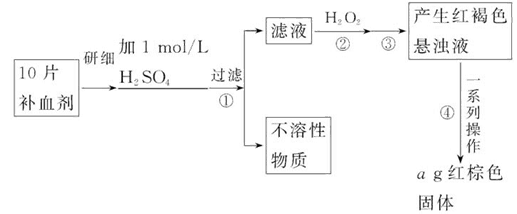
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加_______,该过程的现象为:__________________________________________。
(2)步骤②加入过量H2O2的目的是:____________________________________。
(3)步骤③中反应的离子方程式是:_____________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、_______、灼烧、_______、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为_______g。
查看答案和解析>>
科目: 来源: 题型:填空题
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应C+G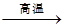 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I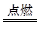 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。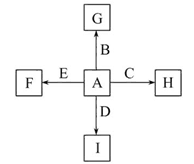
回答问题:
(1)①中反应的化学方程式为:________________________________________;
(2)1.6 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出离子方程式和计算过程);__________________________________________。
(3)C与过量NaOH溶液反应的离子方程式为:___________________________,反应后溶液与过量化合物I反应的离子方程式为:_________________________;
(4)E在I中燃烧观察到的现象是:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com