
科目: 来源: 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: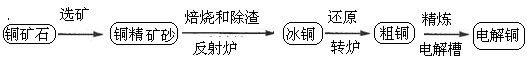
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。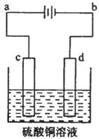
查看答案和解析>>
科目: 来源: 题型:填空题
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目: 来源: 题型:填空题
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。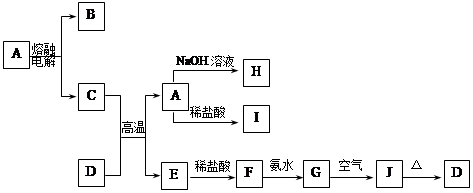
请回答下列问题:
(1)A的化学式为 ,在水中的溶解性 (选填“易溶”、“可溶”、“难溶”)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
反应的现象是 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因 。
查看答案和解析>>
科目: 来源: 题型:填空题
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。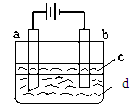
(1)b电极材料为______,其电极反应式为_____________________。
(2)(选择填空)电解时,当在电极上有白色沉淀生成时,电解液d是_____;当在两极之间的溶液中有白色沉淀生成时,电解液d是______。
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题
铁是重要的常见金属材料,也是人类较早使用的金属之一。请运用铁及其化合物的知识,完成下列问题。
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入四氧化三铁和铝粉的混合物,用镁条引燃发生反应,写出发生置换反应的化学方程式并用单线桥法标出电子转移__________________;
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,请问此时分散系中粒子直径的范围是______nm,判断的依据是_________________________;
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________。
(4)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,提出如下假设:
a.只含________________________(填写溶质化学式)。
b.可能组成为___________________(填写溶质化学式)。
(5)欲从废腐蚀液中回收铜,并重新获得FeCl3溶液,设计实验方案如下: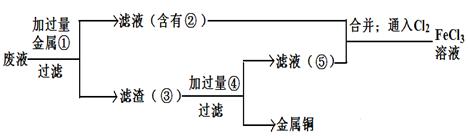
请写出上述实验中加入或生成的有关物质的化学式:
①__________ ③_____________④___________
查看答案和解析>>
科目: 来源: 题型:填空题
硫酸亚铁铵【(NH4)2Fe(SO4)2】俗称莫尔盐,工业上用途广泛,该物质属于 。
A、酸 B、碱 C、盐
某同学为了验证硫酸亚铁铵晶体中的阳离子,进行了如下操作。
(1)室温下,将少量的硫酸亚铁铵晶体配成溶液,并将所配溶液分置于两支试管中,用其中一支进行验证Fe2+的实验,请完成下表:
| 操作 | ①往试管中滴入几滴 溶液(填化学式) | ②继续滴入几滴新制氯水 |
| 现象 | 溶液无明显变化 | 溶液显红色 |
| 原因 | 溶液中没有Fe3+ | (用简要文字说明原因) |
查看答案和解析>>
科目: 来源: 题型:填空题
甲、乙两同学在实验室分别取用不同试剂来制取Al(OH)3【可选试剂有:AlCl3溶液、A12(SO4)3溶液、NaOH溶液、氨水】。
(1)请完成下表:
| | 甲同学 | 乙同学 |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | | |
| 化学方程式 | | A12(SO4)3+6NH3·H2O=2A1(OH)3 ↓+3(NH4)2SO4 |
| 离子方程式 | | |
查看答案和解析>>
科目: 来源: 题型:填空题
根据下列转化关系以及现象回答: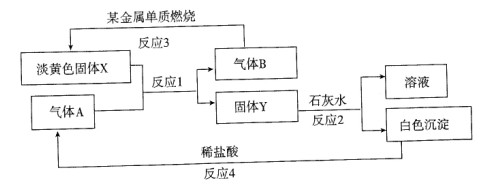
(1)固体X的名称是 ,Y的化学式是 。
(2)写出反应l的化学方程式 。
(3)写出反应2的化学方程式 。
(4)若15.6g X和足量水反应,转移 mol e-。
查看答案和解析>>
科目: 来源: 题型:填空题
铁及其化合物之间的相互转化可用下式表示: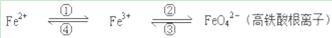
回答下列有关问题:
(1)铁元素在周期表中的位置是___________________________。
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
A.Cl2 B.Fe C.HNO3 D.H2O2
(3)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价),下列说法正确的是________(选填序号)。
A.从物质分类的角度看,黄铜矿属于合金
B.反应中,所有铁元素均被还原
C.反应中,CuFeS2既作氧化剂又作还原剂
D.当转移1 mol电子时,46 g CuFeS2参加反应
(4)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(5)向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体, 该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如右图所示。则混合溶液中HNO3和Fe(NO3)3的物质的量浓度之比为__________。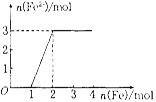
(6)某同学将铁与水蒸气高温反应后的固体物质溶解在过量盐酸中,如何判断所得溶液中是否含有Fe3+? ___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下: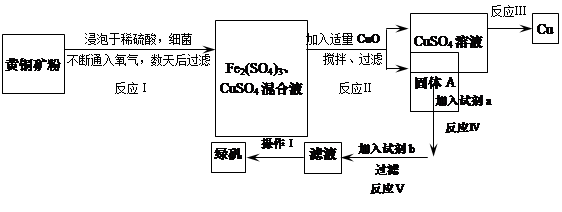
回答下列问题:
(1)已知:
| | Fe2+ | Cu2+ | Fe3+ |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com