
科目: 来源: 题型:问答题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下: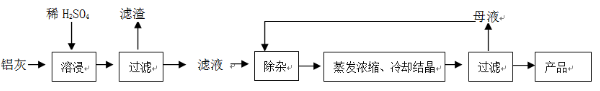
(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目: 来源: 题型:问答题
铝作为材料金属在现代社会中发挥着巨大的作用,铝的化合物在工农业生产及人们的日常生活中也具有广泛地作用。
(1)若将铝溶解,下列试剂中最好选用________(填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
(2)工业制备金属铝利用含有杂质氧化铁和二氧化硅的铝土矿(主要成分为氧化铝)为原料,先制备Al(OH)3。方法是先在铝土矿中加入硫酸,过滤,然后在滤液中加入过量的NaOH溶液,再过滤,在滤液中通入________(一种过量的气体),该反应的离子方程式_______________________________________________。
(3)工业上用电解熔融Al2O3的方法制备金属铝,其阴极反应式为_________。
(4)我国首创以铝、空气、海水为能源的新型电池。该电池以取之不尽的海水为电解液,靠空气中的氧气使铝不断氧化而产生电流。这种海水电池的能量比“干电池”高20~50倍。该新型电池用于航海标志灯已研制成功,只要把灯放入海水中数秒钟,就会发出耀眼的白光。该电池的总反应为:4Al+3O2+6H2O===4Al(OH)3。其负极材料为________,正极反应式为_________________。
(5)碱式氯化铝(分子式可表示为Al2(OH)nCl(6-n)是一种新型无机混凝剂,该产品对工业污水、造纸水、印染水具有较好的净化效果。为确定碱式氯化铝分子式中的n值,可采用沉淀称量法。准确称取碱式氯化铝样品4.97 g,配制成500 mL溶液,用硝酸酸化后,然后逐滴加入过量的AgNO3溶液。然后对沉淀进行过滤、洗涤、干燥,称取沉淀物质量为14.35 g。该碱式氯化铝中的n=________。
查看答案和解析>>
科目: 来源: 题型:问答题
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。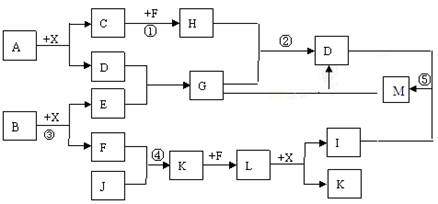
(1)写出化学式:A_________ E___________ L___________;
(2)在反应①②③④⑤中属于氧化还原反应的是_____________;
(3)反应③化学方程式为:______________________________;
(4)写出下列离子方程式:反应② ;G溶液与M溶液的反应___________。
查看答案和解析>>
科目: 来源: 题型:问答题
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下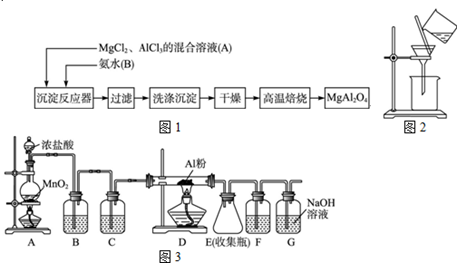
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”“B”或),再滴加另一反应物。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如下图所示,过滤操作中的一处错误是 。
(3)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是 ,F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 ;
查看答案和解析>>
科目: 来源: 题型:问答题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: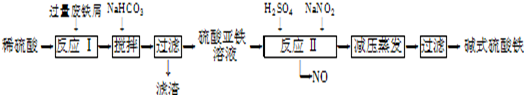
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 来源: 题型:问答题
元素铝是在生产、生活中应用广泛的金属元素。
(1)从矿石提取氧化铝:矿石与NaOH溶液高温反应,然后降温析出晶体,再经净化和高温煅烧得到氧化铝。降温析出晶体时的反应方程式为: 。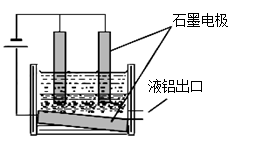
(2)氧化铝是工业电解冶炼铝的重要原料,生产中加入冰晶石(Na3AlF6),其作用是 。
工业冶炼铝的装置示意图如右:
①阴极的反应式 ,
②在电解池工作过程中,需要不断补充阳极材料,原因是 。
(3)有资料介绍:溶液中铝元素以氢氧化物[用Al(OH)3表示]形式存在的pH范围是3.8~10。现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 。
(4)一种新型高效净水剂PAFC——聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。有关PAFC的说法正确的是 。(填选项)
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性和强碱性溶液中都能稳定存在
查看答案和解析>>
科目: 来源: 题型:问答题
(14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操 作 | 现 象 |
通入氯气至过量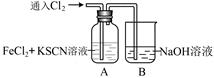 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
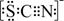 。
。查看答案和解析>>
科目: 来源: 题型:问答题
(6分) 向1L AlCl3和FeCl3混合溶液中加入2mol /LNaOH溶液300mL时,产生的沉淀量达最大值;继续加入NaOH溶液,沉淀开始溶解,当加入NaOH溶液的总体积达到 350mL时,沉淀不再减少,求原溶液中FeCl3的物质的量浓度(需写出解题过程)。
查看答案和解析>>
科目: 来源: 题型:问答题
A~G各物质间的关系如下图,其中B、D为气态单质.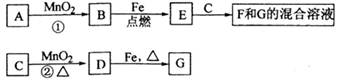
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①若能在常温下进行,其化学方程式为________;
若只能在加热情况下进行,则反应物A应为________;
(3)反应②的化学方程式为_____________________;
(4)新配制的F溶液应加入________以防止其转化为G,检验G溶液中阳离子的常用试剂是________,实验现象为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com