
科目: 来源: 题型:实验题
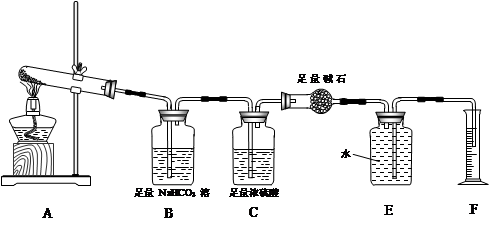
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带火星的木条插入试管C中的溶液上方,木条复燃。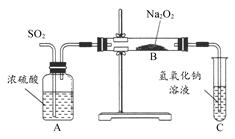
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是 。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3: 。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案: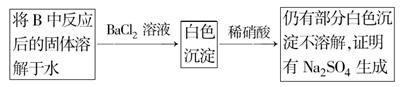
上述方案是否合理? 。请简要说明两点理由:① ;② 。
查看答案和解析>>
科目: 来源: 题型:实验题
为了“探究铁及其化合物的氧化性或还原性”.
(1)实验前同学预测:Fe2+肯定既有还原性又有氧化性.你认为他预测的依据是:__
(2)甲同学欲用实验证明他的预测.实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L -lFeCl2溶液、KSCN溶液、新制氯水.
①若计划在0.1 mol·L-l FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生反应的离子方程式为
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+反应的产物的存在以获取证据.你认为可选_____滴入小明所得的混合液中,并通过溶液出现___色的现象,证明该同学的观点和实验方案都是正确的.
③对于证明Fe2+具有氧化性,该同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为________.
(3)甲同学分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为该同学梳理相关问题:若Fe2+在反应中表现出氧化性应转化成______(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成_____.
②实际上Fe2+还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是: ,相关反应的离子方程式:_____ .
查看答案和解析>>
科目: 来源: 题型:实验题
我国化工专家侯德榜,勇于创新,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。请完成下列问题:
(1)“联合制碱法”制得的“碱”是 (填化学式)。
(2)氨碱法和联合制碱法是两大重要的工业制碱法,下列表达中,不正确的是 。
| | | 氨碱法 | 联合制碱法 |
| A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B | 可能的副产物 | 氯化钙 | 氯化铵 |
| C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |

查看答案和解析>>
科目: 来源: 题型:实验题
某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:① 2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2 SO4+ 2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。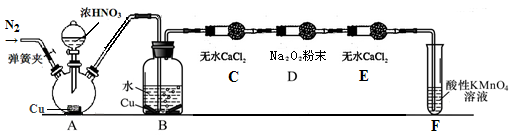
①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中发生反应的实验是 。
查看答案和解析>>
科目: 来源: 题型:实验题
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价。
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
|
 【实验过程】
【实验过程】查看答案和解析>>
科目: 来源: 题型:实验题
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,
通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。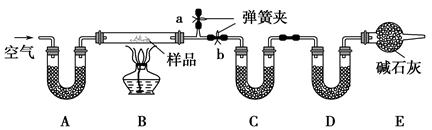
(1)加热前通入空气的目的是 ,
操作方法为 。
(2)装置A、C、D中盛放的试剂分别为:A ,
C ,D 。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3·10H2O的含量将 。
(4)若样品质量为w g,反应后C、D增加的质量分别为m1 g、m2 g,由此可知混合物中NaHCO3的质量分数为 (用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:实验题
某课外兴趣小组为探究某种合金(含Mg、Al)中铝的含量,设计如图装置进行实验。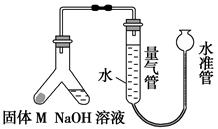
(1)如何检查该装置的气密性? 。
(2)写出该合金与氢氧化钠溶液反应的离子方程式: 。
(3)使足量氢氧化钠溶液与a g合金(固体M)充分反应,进入量气管的气体体积为V mL(已换算成标准状况,下同)。若a=0.036,V=22.4,该合金中铝的质量分数是 。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,与a g合金粉末充分反应,则进入量气管内的气体体积 (填“>”、“<”或“=”)V mL;利用测得的气体体积能否对合金中的Al含量进行计算? (填“能”或“否”)。
查看答案和解析>>
科目: 来源: 题型:实验题
一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2: 。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为 。
(3)进行实验
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。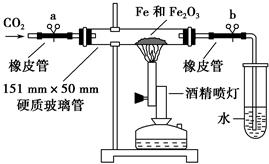
①按如图装置连接好仪器(暂不装入药品), 。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹, ,即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 | 预期现象和结论 |
| | |
查看答案和解析>>
科目: 来源: 题型:实验题
为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。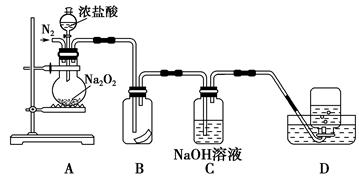
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,有气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条退色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;② 。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。 Na2O2+
Na2O2+ HCl=
HCl= Cl2+
Cl2+ NaCl+
NaCl+ 该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
查看答案和解析>>
科目: 来源: 题型:实验题
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com