
科目: 来源: 题型:问答题
以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)已知: (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(2)沸腾炉中发生反应的化学方程式为 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.沸腾炉排出的矿渣可供炼铁
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.为使黄铁矿充分燃烧,需将其粉碎
(4)在吸收塔吸收SO3不用水或稀硫酸的原因 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是 。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表(a>0): 
计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g,浓硫酸增加的质量为 。(计算结果保留两位小数)
查看答案和解析>>
科目: 来源: 题型:问答题
(13分)平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
已知:
ⅰ.酸性条件下,铈在水溶液中有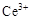 、
、 两种主要存在形式,
两种主要存在形式,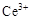 易水解,
易水解, 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1).操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(2).反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(3).写出反应①的化学方程式 。
(4).用滴定法测定制得的Ce(OH)4产品纯度。
滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5).称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
查看答案和解析>>
科目: 来源: 题型:问答题
(18分)工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH3与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物 的处理过程。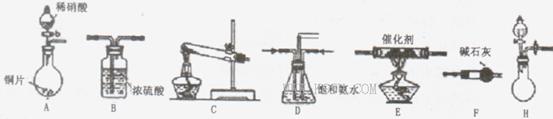
I.探究制取NH3的方法
(1)B装置的名称:______________
(2)在上述装置中,H能快速、简便制取,装置中需要添加的反应试剂为_________ 。
(3)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
分析表中数据,你认为哪种方案制取氨气的效果最好________(填序号),从该方案选择的原料分析制气效果好的可能原因是________,__________。
| 试剂组合序号 | 固体试剂 | NH3体积(mL) | |
| a | 6.0gCa(OH)2过量 | 5.4gNH4Cl | 1344 |
| b | 5.4g(NH4)2SO4 | 1364 | |
| c | 6.0gNaOH过量 | 5.4gNH4Cl | 1568 |
| d | 5.4g(NH4)2SO4 | 1559 | |
| e | 6.0gCaO过量 | 5.4gNH4Cl | 1753 |
| f | 5.4g(NH4)2SO4 | 1792 | |

查看答案和解析>>
科目: 来源: 题型:问答题
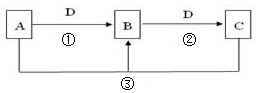
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 ,工业上制取A的离子方程式Ⅰ为 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是 。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式 ;
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。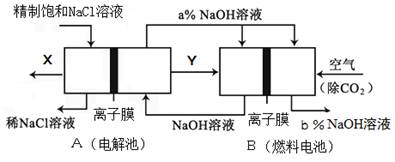
(6)Ⅰ①图中X、Y分别是 (填化学式),分析比较图示中氢氧化钠质量分数a% b%(填“>”、“=”或“<”)
②写出燃料电池B中负极上发生的电极反应 。
查看答案和解析>>
科目: 来源: 题型:问答题
(15分)
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。
查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾。
Ⅰ.化合物SO2Cl2中S元素的化合价是 。
Ⅱ.用二氧化锰和浓盐酸制氯气的化学方程式是 。
Ⅲ.在收集氯气前,应依次通过盛有饱和食盐水和 的洗气瓶。
Ⅳ.用如图所示装置收集满Cl2,再通入SO2,集气瓶中立即产生无色液体,
充分反应后,将液体和剩余气体分离,进行如下研究。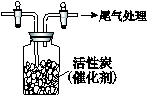
(1)研究反应的产物。向所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl- ,证明无色液体是SO2Cl2。
① 写出SO2Cl2与H2O反应的化学方程式 。
② 检验该溶液中Cl-的方法是 。
(2)继续研究反应进行的程度。用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀。
① 该白色沉淀的成分是 。
② 写出SO2与Cl2反应的化学方程式,并阐述理由______。
查看答案和解析>>
科目: 来源: 题型:问答题
(14分)
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。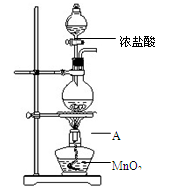
(1)仪器A的名称为 ;A中反应的离子方程式为 。
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3溶液 | 出现白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:问答题
(15分)
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
| 操作 | 现象 |
 a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 | |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |

查看答案和解析>>
科目: 来源: 题型:问答题
(12分)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。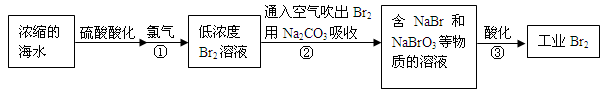
(1)NaBr的电子式是 。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是 。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是 。
(4)反应②的化学方程式是 。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是 mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBrb.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目: 来源: 题型:问答题
(8分) 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即有漂白、杀菌的性能,其原理是(用化学反应方程式表示) 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
查看答案和解析>>
科目: 来源: 题型:问答题
火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有 (填写字母编号)
A水体富营养化 B重金属污染 C雾霾 D酸雨
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式 。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
A的化学式 ,若生成ag A,理论上可以回收SO2的质量为 g。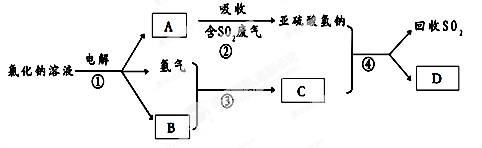
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式 。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com