
科目: 来源: 题型:实验题
实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ
验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器。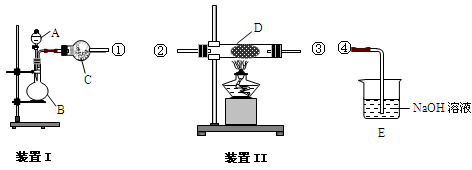
请回答下列问题:
(1)①仪器A的名称是 ,仪器B中应加入的固体药品 (填化学式);
②实验中观察到D内红棕色气体的化学式为 ,证明氨气具有 性;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为 ;
②此时仪器C中改为盛装P2O5 的作用是 。
查看答案和解析>>
科目: 来源: 题型:实验题
某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题: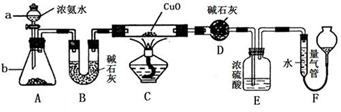
(1)仪器a的名称为____________;仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)E装置中浓硫酸的作用是____________________________________。
(4)F中读取气体体积前,应对装置F进行的操作是:___________________,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”);图中量气管可由________ (请选择字母填空:A.酸式滴定管,B.碱式滴定管)改装而成。
(5)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________。
A.B装置实验前后质量差mg; B.F装置实验前后液面差VL
C.D装置实验前后质量差mg; D.E装置实验前后质量差mg;
查看答案和解析>>
科目: 来源: 题型:实验题
下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置: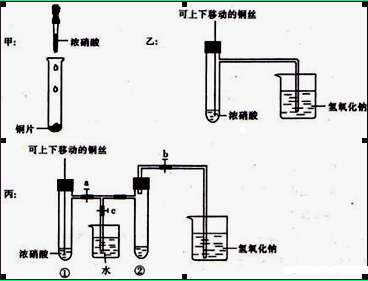
(1)甲、乙、丙三个装置中共同发生的化学方程式是 。
(2)和甲装置相比,乙装置的优点是可以控制反应的开始与停止,还可以 。
(3)为了进一步验证NO2和水的反应,当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的 水进人②试管,应如何操作?
查看答案和解析>>
科目: 来源: 题型:实验题
某课外兴趣小组为探究铜跟浓硫酸反应情况,用下图所示装置进行实验。已知:①SO2难溶于饱和亚硫酸氢钠溶液;②SO2能与酸性高锰酸钾溶液发生氧化还原反应使之褪色(化学方程式为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4)。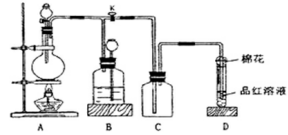
回答下列问题(注:E为止水夹,F为旋塞):
(1)检查A装置的气密性的方法 。
(2)装置A中反应的化学方程式为 。
(3)装置D中试管口放置的棉花应蘸有NaOH溶液,
其作用是 。
(4)装置B具有贮存气体的作用。当D处有明显的现象后,关闭旋塞F并移去酒精灯,由于余热的作用,A处仍有气体产生,此时B中的现象是 ,B中应放置的液体是(填字母) 。
| A.水 | B.饱和NaHSO3溶液 | C.酸性KMnO4溶液 | D.NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:实验题
某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验(实验室制取氯气的反应为MnO2 + 4 HCI(浓) MnCl2 + C12↑+ 2 H2O):
MnCl2 + C12↑+ 2 H2O):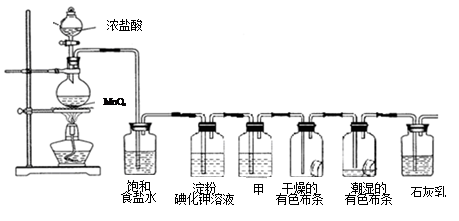
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是_________,反应的离子方程式____________。
(2)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放________(填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为___________________。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2______________L。
查看答案和解析>>
科目: 来源: 题型:实验题
Na2S2O3·5H2O(俗称海波或大苏打)是照相业常用的一种定影剂。
(一)常用下列途径制备海波:
已知反应:4FeS+7O2  2Fe2O3+4SO2、Na2SO3+S
2Fe2O3+4SO2、Na2SO3+S Na2S2O3
Na2S2O3
(1)计算原料FeS在反应(a)和(b)中的理论分配比:_________。
(2)现有88gFeS,设NaOH溶液吸收SO2的吸收率为96%,问最多制备海波质量为____克(精确到0.1克)
(二)工业上制得的海波晶体中可能含有少量的亚硫酸钠和硫酸钠杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后过滤出硫,微热滤液使生成的SO2全部逸出(Na2S2O3+ H2SO4® Na2SO4+ SO2↑+ S↓+ H2O)。测得有关实验数据如下(标准状况):
| | 第一份 | 第二份 | 第三份 |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.80 | 1.60 | 3.20 |
查看答案和解析>>
科目: 来源: 题型:实验题
下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.
(一)甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学反应方程式是:__________,C装置中盛放的液体药品的名称是______________。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察__________得知.
(3)本实验在设计上_________(填有、无)缺失之处?若有请给出改进方案。(若无,此问可不答)
(二)乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式_________________________________。
(5)对于A处,乙认为不需加热装置。则A处仪器中分别放置的药品为:分液漏斗中____________圆底烧瓶中_________
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基本一致,那么C处的广口瓶应改为__________所装药品为_____________。
查看答案和解析>>
科目: 来源: 题型:实验题
为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。 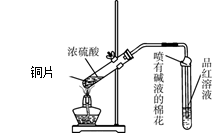
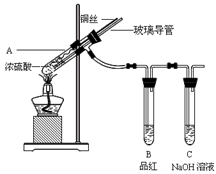
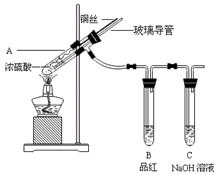 图1 图2
图1 图2
(1)比较两实验装置,图2装置的优点是:① ;② 。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是 。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
| A.过量铁粉 | B.氯化钡溶液 | C.银粉 | D.碳酸氢钠溶液 |
查看答案和解析>>
科目: 来源: 题型:实验题
单晶硅是信息产业中重要的基础材料。通常用焦炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。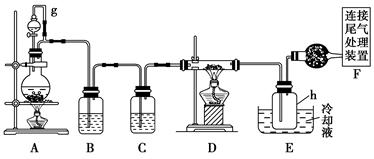
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
科目: 来源: 题型:实验题
某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),请按要求回答下列问题。
(1)下列方法中,可制得Cl2的正确组合是 。
①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热;③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合;⑤KClO3和浓盐酸混合共热;⑥KMnO4和浓盐酸混合。
A.①②⑥ B.②④⑥
C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式 。
(3)①装置B的作用是 ;
②装置C和D出现的不同现象说明的问题是 ;
③装置E的作用是 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置 与 之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为 (填字母序号)。
A.湿润的碘化钾淀粉试纸 B.浓硫酸
C.湿润的红色布条 D.饱和食盐水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com