
科目: 来源: 题型:实验题
为了证明一氧化碳具有还原性,有人设计了下列实验:
(1)装置B中最适宜的试剂是___________________________________________。
(2)装置D中发生反应的化学方程式是___________________________________。
(3)必须用装置C吸收除去气体中水蒸气的理由是_________________________。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置______与______之间连接下列装置中的______(填序号)。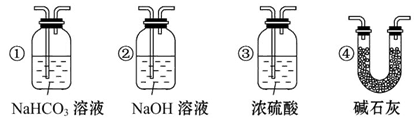
查看答案和解析>>
科目: 来源: 题型:实验题
某学习小组设计用如图装置验证二氧化硫的化学性质。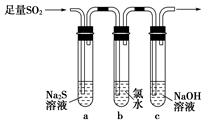
(1)能说明二氧化硫具有氧化性的实验现象为_________________________。
(2)为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为____________________________________________。
(3)当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:实验题
某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告。
| 物质 | 类别 | 化学性 质预测 | 实验验证 | ||
| 实验操作 | 实验现象 | 实质(用离子 方程式表示) | |||
| 二氧 化硫 | 酸性 氧化物 | 与水 反应 | 将盛满SO2气体的试管倒立在水中,并测定试管中溶液的pH | ① | SO2+H2O H2SO3 H2SO3 |
| 与碱 反应 | ② | 出现白 色沉淀 | ③ | ||
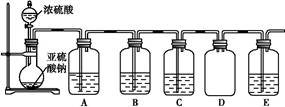
| 装置 | 药品 | 作用 |
| A | | 验证二氧化硫的还原性 |
| B | | |
| C | 品红溶液 | |
查看答案和解析>>
科目: 来源: 题型:实验题
某化学兴趣小组为了探究某些气体的性质,设计了如图所示的实验装置。实验时将A、D中产生的气体同时通入C中。(K为止水夹,部分夹持仪器已略去)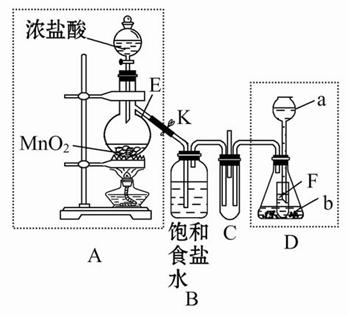
回答下列问题:
(1)简述实验前检查A部分装置气密性的方法_______________________________________。
(2)仪器E的名称是______,锥形瓶内小试管F的作用是______。
(3)若b是生石灰,a是______时,在C中有白烟产生,写出生成白烟的化学方程式________________________。
(4)若a是质量分数为75%的硫酸,b是亚硫酸钠粉末,在C中盛适量的BaCl2溶液时,写出C中发生反应的离子方程式:____________。
(5)从环保的角度出发,上述实验装置中需要改进的是____________________________________________。
查看答案和解析>>
科目: 来源: 题型:实验题
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4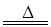 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
试回答:(1)该实验中A部分的装置是____(填写装置的序号)。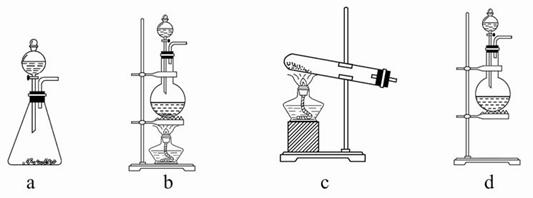
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):____________________________。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式
__________________。
(4)该实验存在明显的缺陷,请你提出改进的方法___________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为: 2Na2S2O3+I2=Na2S4O6 + 2NaI 反应完成时,共用去Na2S2O3
20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为:_____________。
查看答案和解析>>
科目: 来源: 题型:实验题
图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先___ _____,在E中装入水,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。
查看答案和解析>>
科目: 来源: 题型:实验题
如图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热及固定装置均略去),仪器装置可任意选择,必要时可重复选用。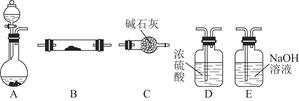
请回答下列问题:
(1)在装置A的圆底烧瓶中装入锌片,分液漏斗中装入稀硫酸,以验证H2的还原性并检验其氧化产物。
①若按顺序A→D→B→B→C连接时,则两次使用的装置B中所盛放药品的化学式依次为CuO、 (填化学式)。
②检验装置的气密性后,在加热装有CuO的装置B前必须进行的操作是 。
(2)在装置A的锥形瓶中装入Na2O2,分液漏斗中装入浓氨水,装置B中装入固体催化剂,以进行氨的催化氧化。
①若装置的连接顺序为A→C→B→C,则装置B中氨的催化氧化反应的化学方程式为 ,装置B中可能观察到的现象是 。
②若把装置A制得的气体与Cl2混合在一起,产生白烟,写出反应的化学方程式 。该反应体现了氨的 性。
查看答案和解析>>
科目: 来源: 题型:实验题
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计的制备Na2S2O3·5H2O的装置和部分操作步骤如下。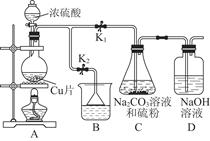
Ⅰ.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液经过 、 、过滤、洗涤、烘干,得到产品Na2S2O3·5H2O。
①Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 (用离子方程式表示)。
②Ⅳ中,操作步骤是 、 。
③装置B中盛放的试剂是(填化学式) 溶液。
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因 。
(2)常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 0 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准 | | | | |
| 溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目: 来源: 题型:实验题
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。(固定装置已略去)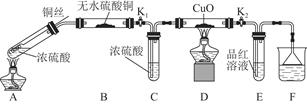
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目: 来源: 题型:实验题
某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如图所示装置: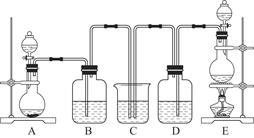
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的特质有________________。
(2)反应开始后,发现B、D两个集气瓶中的品红溶液都褪色,停止通气后,用热水浴给B、D两个集气瓶加热。两个集气瓶中的现象分别为:B____________________;D____________________。
(3)装置C的作用是______________________________________________________。
(4)该实验小组的甲、乙两位同学利用上述两个发生装置按图所示装置继续进行实验: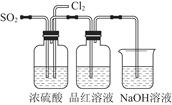
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题:
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸中的目的:________________________________________________________________________________________________________________________________________________。
②试分析甲同学实验过程中,品红溶液不褪色的原因是____________________________________________________________________________________________________________________________________________________________________________________________________________________。(结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com