
科目: 来源: 题型:实验题
工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH3与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。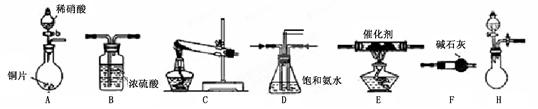
I.探究制取NH3的方法
(1)在上述装置中,H能快速、简便制取NH3,装置中需要添加的反应试剂为 。
(2)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
| 试剂组合序号 | 固体试剂 | NH3体积(mL) | |
| a | 6.0 g Ca(OH)2(过量) | 5.4 g NH4Cl | 1344 |
| b | 5.4g (NH4)2SO4 | 1364 | |
| c | 6.0 g NaOH(过量) | 5.4 g NH4Cl | 1568 |
| d | 5.4g (NH4)2SO4 | 1559 | |
| e | 6.0 g CaO(过量) | 5.4 g NH4Cl | 1753 |
| f | 5.4 g (NH4)2SO4 | 1792 | |
查看答案和解析>>
科目: 来源: 题型:实验题
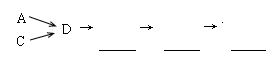
下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题: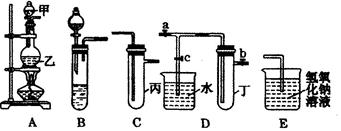
(1)将A、C、E相连后,以浓盐酸和 (填写名称)为原料制取Cl2,仪器乙的名称是 。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
查看答案和解析>>
科目: 来源: 题型:实验题
甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。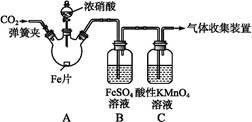
文献记载:Ⅰ.在浓硝酸与活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物。
Ⅱ.FeSO4+NO Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
| 加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
查看答案和解析>>
科目: 来源: 题型:实验题
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| | 酸 | 实验结果 |
| a | 浓硫酸 | 加热后发生反应,产生无色刺激性气体 |
| b | 稀硫酸 | 加热也不发生反应 |
| c | 浓硝酸 | 不加热即发生反应,产生红棕色气体 |
| d | 稀硝酸 | 微热发生反应,产生无色气体 |


查看答案和解析>>
科目: 来源: 题型:实验题
某实验小组设计了下列装置进行氨的催化氧化实验。
(1)常温下,用5.8 mol/L的氨水时实验现象明显,现用浓氨水配制该浓度的氨水480mL,需要烧杯、玻璃棒,还需要的玻璃仪器有 。
(2)甲处药品的名称为_____________。
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是_____(填“吸”或“放”)热反应,化学方程式为 ;乙处加入无水氯化钙,烧瓶中发生反应的化学方程式为___ ;锥形瓶中产生的现象为 _。
(4)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生的现象为 。
(5)现用镁与石墨作电极,浓氯化铵溶液作电解液构成原电池,正极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:实验题
某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。
(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
查看答案和解析>>
科目: 来源: 题型:实验题
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。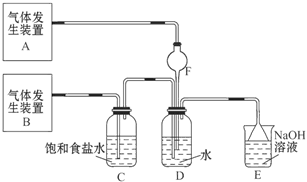
(1)气体发生装置A产生的气体是_____________。
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:①氯化铁溶液;②氯化亚铁溶液;③硫氰化钾溶液;④苯酚溶液;⑤品红溶液; ⑥酸性高锰酸钾溶液
Ⅰ.若Cl2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,再加入____________(选填一个序号)试剂,实验现象是: 。
Ⅱ.若SO2过量:取适量D中溶液滴加至盛有____________(选填一个序号)的试管内,实验现象是:__________________________________。
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?____________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:实验题
安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3溶液的反应[0.1mol/L的Fe(NO3)3溶液的 pH=2]做了相应探究。
探究I
(1)某同学进行了下列实验:取12.8g铜片和20 mL 18 mol?L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。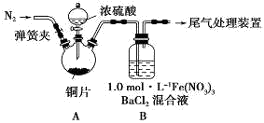
①配制1mol/L 的Fe(NO3)3溶液,需准确称量一定质量的Fe(NO3)3固体,在烧杯中溶解恢复到室温后,将溶液转移到容量瓶中,再经过洗涤、定容、摇匀可配得溶液,请回答将溶液转移至容量瓶中的操作方法________________________________。
②装置A中反应的化学方程式是_________________________________________。
③该同学设计求余酸的物质的量实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重
B.将产生的气体缓缓通入足量Na2S溶液后,测量所得沉淀的质量
C.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
探究II
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是____________________。
(3)装置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1: SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO3-反应;
猜想3:____________________________________;
①按猜想1,装置B中反应的离子方程式是______________________________,证明该猜想1中生成的还原产物,某同学取少量溶液滴加几滴酸性高锰酸钾溶液,紫红色褪去,请分析该同学做法是否正确_________(填“正确”或“不正确”),理由是__________________________________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
A.1 mol/L 稀硝酸
B.pH=1的FeCl3溶液
C.6.0mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
查看答案和解析>>
科目: 来源: 题型:实验题
某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
它们制备SO2和Cl2所依据的原理分别是:
Na2SO3+H2SO4= Na2SO4+H2O+SO2↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)用来制取Cl2的装置是 (填序号),反应中浓盐酸所表现出的化学性质是 和
(2)反应开始一段时间后, B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,____ __ (填“B”或“D” )试管中无明显现象。
(3)装置C的作用是 ;
(4) 若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是 。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:实验题
已知Cl2和碱溶液在不同条件下,得到的产物不同。某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。(3Cl2+6KOH KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )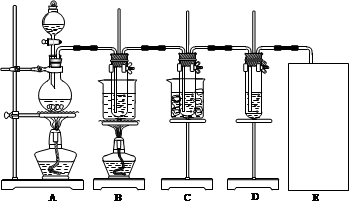
图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过 (填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式为 。需要向烧瓶中加碎瓷片吗? (选填:“需要”、“不需要”)。
(2)反应结束后,烧瓶里的溶液 。
A一定显酸性;B可能显酸性,也可能为中性;C只有氧化性;D只有还原性;E既有氧化性又有还原性
(3)反应完毕,B试管中有少量晶体析出,经冷却后,有大量晶体析出。图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体必须用到的玻璃仪器有 。
(4)该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有HCl气体。对此问题可以通过改进实验装置的方法进行避免。方法是 。
(5)实验中可观察到D的试管里溶液的颜色由紫色先变为_________色,最终变为________色。
(6)C装置中反应完毕的现象是______________________________________________。
(7)请在装置图方框中画出缺少的实验装置,并注明试剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com