
科目: 来源: 题型:实验题
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。 (1)T业上用黄铁矿(FeS2)在高温下和氧气反应制备SO2:4FeS2+11O2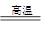 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率(已知SO3。熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)。
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______。
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
③实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
(3)某兴趣小组欲在绿色环保的条件下探究SO2的性质,设计如下图实验装置。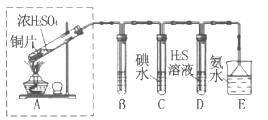
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为_______;
C中反应的离子方程式为______ ;D中的实验现象为______ ;E装置的作用是______。
查看答案和解析>>
科目: 来源: 题型:实验题
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。反应一段时间后,停止加热。回答下列问题: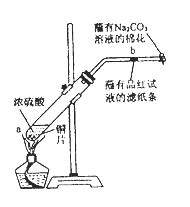
(1)写出a处反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)待试管中的液体冷却后,将试管上层液体倒去,再将剩余物质慢慢加入水中,可观察溶液呈 色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是 ,反应的化学方程式为 。
(5)若用浓度为18 mol/L的浓硫酸100 mL与过量的铜片,加热使之反应,则被还原的硫酸(选填“大于”、“等于”或“小于”) 0.9 mol 。
查看答案和解析>>
科目: 来源: 题型:实验题
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。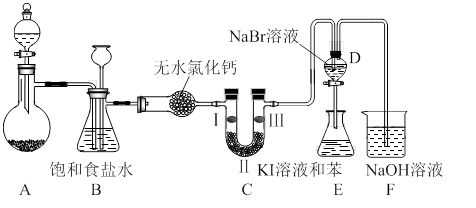
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为: 。
(2)装置B的作用是 ,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 。(选a或b或c)
| | a | b | c |
| I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目: 来源: 题型:实验题
某化学课外小组利用下图装置探究SO2的性质。
请回答下列问题:
(1)装置甲中A仪器的名称是_____________,烧瓶内发生反应的化学方程式为_____________________________________。
(2)装置乙中出现的现象是_______________________________,可以证明SO2具有______(填代号)。装置丙中发生反应的化学方程式为______________________,可以证明SO2具有______(填代号)。
A.氧化性 B.还原性 C.漂白性
(3)收集SO2气体可以选择的装置为______(填代号)。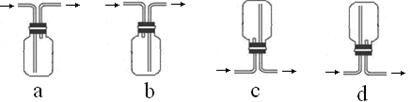
从环保的角度考虑,收集装置的出气口需要连接一个盛有_________(填化学式)溶液的洗气瓶。
查看答案和解析>>
科目: 来源: 题型:实验题
下图是实验室制备四氯化硅的装置示意图。已知:四氯化硅遇水极易反应。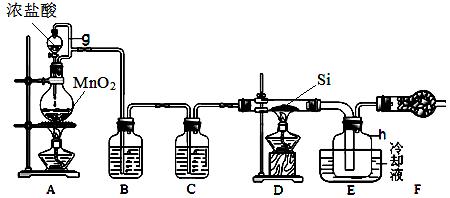
请回答下列问题:
(1)写出装置A中发生反应的化学方程式 。
(2)装置A中g管的作用是 。
干燥管F中碱石灰的作用是 。
该组实验装置中存在的缺陷是 。
查看答案和解析>>
科目: 来源: 题型:实验题
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。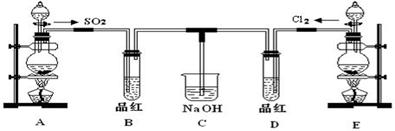
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是 。
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为 。
MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为 。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B: ,D: 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B: ,D: 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
。
查看答案和解析>>
科目: 来源: 题型:实验题
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。探究二氧化硫的制取和性质都有着非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2:
该反应中被氧化的元素是__________(填元素符号)。当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为________L。
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是_______(填写字母)。
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠_______g(保留一位小数)。
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质。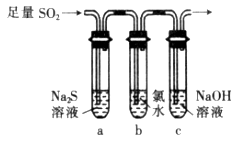
①能说明二氧化硫具有氧化性的实验现象为___________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:实验题
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同。
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属单质、NO2和O2。
2KNO3 2KNO2↑+O2↑
2KNO2↑+O2↑
2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足
量的稀H2SO4得到相应两份溶液,进行以下探究实验。
【提出猜想】猜想一:Fe元素只显+2价;
猜想二:Fe元素只显+3价;
猜想三:Fe元素____ _____。
【实验操作】①向一份溶液中滴入KSCN溶液②将稀酸性KMnO4溶液中滴入另一份溶液
【实验现象】实验① ;实验② 。
【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)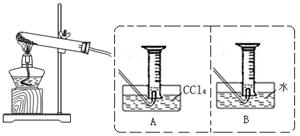
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重
新连接好仪器;④加热;⑤……
(1)乙同学使用A装置收集气体,恰好收集到常温常压下27mL的红棕色气体,为确保数据的准确性,读数时必须 。
(2)乙同学用带火星木条检验量筒内气体时,发现木条燃烧,且颜色变浅甚至无色,下列判断中正确的是 。
a.气体中只有NO2 b.气体是O2、NO2的混合物
c.支持燃烧的气体只有O2 d.NO2支持燃烧
(3)丙同学取等质量的Fe(NO3)2使用B装置收集气体,可收集到 mL气体。
【实验三】探究固体混合物的成分。小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是( )
| A.1:2:2 | B.2:1:3 | C.1:2:3 | D.3:8:6 |
查看答案和解析>>
科目: 来源: 题型:实验题
研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。
(1)D中的实验现象是 ,C、E中溶液都褪色,分别体现SO2 、 性质。
(2)请在方框中画出收集SO2以及尾气处理装置(标相关试剂)。
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀不溶解,你认为留下的沉淀物是 ,形成该沉淀的反应方程式有: 。
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。研究小组改进A装置(如右图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是 (填序号,不定项选择)
A.CO2 B.NH3 C.O3 D.N2 E.NO2
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:
①沉淀洗涤要干净,检验洗涤已经干净的实验操作是 。
②试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。
查看答案和解析>>
科目: 来源: 题型:实验题
如图是某研究性学习小组设计的SO2与Na2O2反应的探究装置.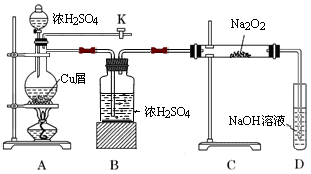
(1)实验开始时,打开旋塞K,通入N2排尽整套装置中的空气,关闭旋塞K。点燃酒精灯,A中反应的化学方程式是 。
(2)B装置的作用是 。
(3)反应过程中,观察到:A中出现黑色不溶物;C中固体由淡黄色逐渐至完全转化为白色;若将带火星木条伸入D试管口内,火星显得更明亮。
①停止加热后,再通入N2至整套装置冷却,其目的是 。
②取少量C中白色固体,溶于蒸馏水得无色溶液W 。若向W中滴加几滴酸性KMnO4溶液,振荡,紫色褪去;若向W中加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀;则说明C中白色固体有 。
③D装置中发生反应的离子方程式是 。
④过滤出A装置中的黑色不溶物,洗涤后将其溶于浓硝酸,得到蓝色溶液并产生红棕色气体;向蓝色溶液中滴加BaCl2溶液,产生白色沉淀;则黑色物质可能是___________。
a.Cu b. CuO c.CuS d.Cu2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com