
科目: 来源: 题型:填空题
(12分)已知金属单质A是生产生活中用量最大的金属。 D是难溶于水的白色固体。 F为红褐色固体。无色气体甲遇气体丙立即生成红棕色的气体乙。(图中部分产物和反应的条件略)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式C__________G__________。
写出反应①的化学方程式________________________________ 。
反应②的离子方程式_____________________________。
(3)反应④整个过程观察到的现象为_____________________________。
(4)反应⑤中,若将充满气体乙的试管倒扣在水槽中,充分反应后,试管内液体占试管总体积_______________。
(5)某种贫血症患者应补充C物质的阳离子。含该离子的药片外表包有一层特殊的糖衣,这层糖衣的作用就是保护该离子不被空气中的氧气氧化。为检验长期放置的药片已经失效,将药片去除糖衣后研碎,取少量研碎的药片放入烧杯中,加适量的蒸馏水,然后滴加数滴__________溶液,溶液显__________色,表明该药片已失效。
查看答案和解析>>
科目: 来源: 题型:填空题
2016年奥运会将在里约热内卢举行,下图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成。A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2。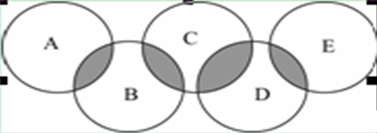
(1) D的化学式为________。
(2)A、B、E中含有一种相同的元素,其名称为________。
(3)B和E反应可生成一种单质和一种常见的液态化合物,写出化学方程式________。
(4)写出C与氢氧化钾溶液反应的离子方程式___________。
查看答案和解析>>
科目: 来源: 题型:填空题
在下列物质转化关系中,反应的条件和部分产物已略去。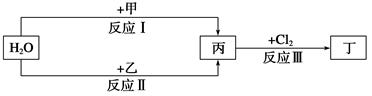
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
①反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是________(填字母)。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是______________________________________。
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性________(填“强”或“弱”),比较二者金属性强弱的依据还可以是(写出一种即可)__________________。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是__________________________________________________。
②反应Ⅰ的另一种产物为有机物,则该有机物的电子式是______________。
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离子方程式是______________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。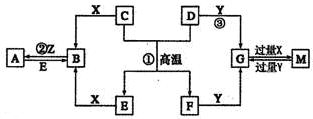
(1)写出X的电子式: 。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为 (写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式: 。
(4)写出反应③的离子方程式: 。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别 (回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明 。
查看答案和解析>>
科目: 来源: 题型:填空题
物质的转化关系如图所示(有的反应可能在水溶液中进行)。其中甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成。请回答下列问题: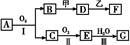
(1)写出甲的电子式: 。
(2)写出反应Ⅰ的化学方程式: 。
(3)A溶于水得到溶液X,在25 ℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为 ,
用含a和b的代数式表示出该混合溶液中X的电离平衡常数 。
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0~6.0之间,通过如图装置处理污水。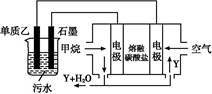
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ. ;Ⅱ. 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分Y物质参加循环(见上图)。Y物质的化学式是 。
查看答案和解析>>
科目: 来源: 题型:填空题
如图表示常见元素单质及化合物相应关系,某些生成物已略去。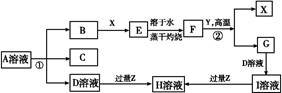
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分。请回答下列问题:
(1)D的电子式 ;H为 (填化学式)。
(2)完成下列方程式:
①空气中含量最高的气体与C反应的化学反应方程式 ;
②反应②的化学反应方程式 ;
③足量B通入H溶液的离子反应方程式 。
查看答案和解析>>
科目: 来源: 题型:填空题
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示。又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属。②乙在甲中燃烧发出苍白色火焰,E的水溶液呈黄色。回答下列问题: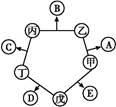
(1)A与B可反应,产物中阳离子的结构式为 。
(2)A与B的沸点比较,较高的是 (写化学式)。
(3)E的水溶液可使KI淀粉溶液变蓝,写出该反应的离子方程式: 。
(4)工业上可由B与丁反应制取C,写出该反应的化学方程式: 。
(5)将甲和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式: 。
(6)用以上金属戊作电极,利用如图装置,可以模拟金属的电化学防护。若X为碳棒,为减缓戊的腐蚀,开关K应置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目: 来源: 题型:填空题
几种中学化学常见的单质及其化合物相互转化的关系图如下: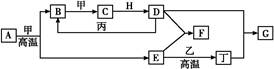
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。A、E、F、G四种物质中含同种元素。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为 ,每反应1 mol的A转移的电子为 mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式: ;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
试将①、②、③三个序号以及对应的分散质具体的化学式填入下列方框中:
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:填空题
下图所涉及的物质均为中学化学中的常见物质,其中C为无色气体单质,D为有色气体单质,E为金属单质,其余为化合物。它们存在如下转化关系(反应中生成的水及次要产物均已略去)。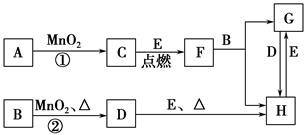
(1)写出有关物质的化学式:F________,H________。
(2)若反应①是在加热条件下进行,则A是________;若反应①是在常温条件下进行,则A是________。
(3)写出B与MnO2共热获得D的化学方程式______________________________。
(4)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,已知Ksp(AgX)=1.8×10-10。将B的稀溶液与AgNO3溶液等体积混合,若B的浓度为2×10-4 mol·L-1,则生成沉淀所需AgNO3溶液的最小浓度为________mol·L-1。若向AgX悬浊液中滴加KI溶液,观察到的现象是______________________________,沉淀能够发生转化的原因是_________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)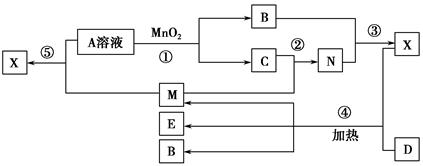
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
_________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为_________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4
b.品红溶液
c.酸性KMnO4溶液
d.澄清石灰水
e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com