
科目: 来源: 题型:单选题
abcd是四种短周期元素。a、b、d同周期,c、d同主族.a原子结构示意图 ,b与c形成化合物的电子式为如图
,b与c形成化合物的电子式为如图 。下列比较中正确的是
。下列比较中正确的是
| A.原子半径:a >c>d | B.非金属性:a >b>d |
| C.单质的熔点:c> a | D.最高价氧化物对应的水化物的酸性:c>d>a |
查看答案和解析>>
科目: 来源: 题型:单选题
下列有关物质性质的比较正确的是
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
| A.①③ | B.②④ | C.③⑥ | D.⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:实验题
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空: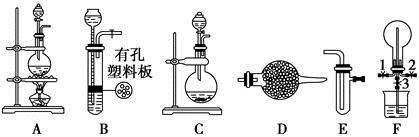
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙
c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子_____________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是_______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式_________________________________________
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:实验题
喷泉是一种常见的现象,其产生原因是存在压强差。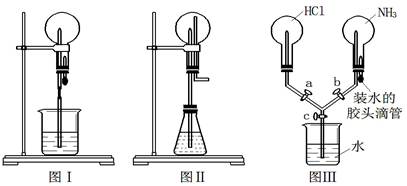
(1)图Ⅰ为化学教学中常用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中能形成喷泉的是
A. SO2和H2O B. CO2和NaOH溶液
C. Cl2和H2O D. NO和H2O
(2)在图Ⅱ的锥形瓶中,分别加入足量的下列物质后,能产生喷泉的是
A. Cu与稀硫酸 B. Cu与稀硝酸 C. Al与浓硝酸 D. Fe与浓硝酸
(3)比较图Ⅰ和图Ⅱ两套装置,从产生喷泉的原理来分析,图Ⅰ是 上部烧瓶内气体压强;图Ⅱ是 下部锥形瓶内气体压强(均填“增大”或“减小”)。
(4)某学生积极思考喷泉原理的应用,设计了如图Ⅲ所示的装置。
① 如果关闭活塞c,打开活塞a、b,再挤压胶头滴管。则可能出现的现象为 。
②在①操作的基础上,若要在该装置中产生双喷泉现象,其操作方法是 。
查看答案和解析>>
科目: 来源: 题型:实验题
用如图所示装置进行实验(夹持装置已略去)。请回答下列问题: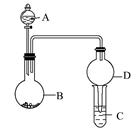
(1)若A中为浓硝酸,B中为铜单质,C中为氢氧化钠溶液。将浓硝酸滴入B中,则B中发生反应的化学方程式为。
(2)若A中为浓氨水,B中为生石灰,C中为明矾溶液。
①将浓氨水逐滴滴入B中,可产生大量氨气,原因可能是(填序号)。
a.生石灰和浓氨水反应产生氨气,氨气易溶于水
b.生石灰和水反应,消耗水,使氨气的溶解量减少
c.反应放出大量热,使氨气在水中的溶解度明显降低
②C中通入过量氨气时,相应的离子方程式为。
(3)若A中为水,B中为过氧化钠,C中为酸性淀粉碘化钾溶液,将水滴入B中后,B中的实验现象为;若C中溶液变为蓝色,则C中发生反应的离子方程式为。
查看答案和解析>>
科目: 来源: 题型:实验题
食用加碘盐的生产流程如下: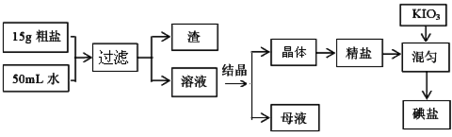
(1)检验母液中是否含有SO42-离子的方法是 。
(2)过滤时,用到的玻璃仪器有: 、 、 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计):出厂产品≥40mg/Kg;销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1 h,即得碘盐产品,该碘盐的含碘量约为______mg/Kg(保留一位小数),是否为合格产品 (选填“合格”或“不合格”)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O→3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要使用的一种试剂是 。
(5)使用碘盐时,要防止高温,是因为:① 碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体中加硝酸酸化的硝酸银溶液有黄色沉淀生成;② 碘盐在热水中,也会反应生成两种单质,其中一种是无色气体,在反应后的溶液中滴加酚酞试液显红色。根据以上信息写出①、②中发生反应的化学方程式:
① ;
② 。
查看答案和解析>>
科目: 来源: 题型:填空题
如图为部分短周期元素化合价与原子序数的关系图。请回答下列问题。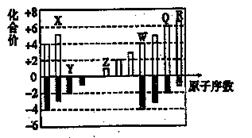
(1)元素Q位于周期表中第 周期______族。
(2)将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分剜得到l L溶液,所得水溶液碱性最强的氢化物的电子式是 。
(3)Z的最高价氧化物对应的水化物与W的单质反应的化学方程式为 。
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。RY2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50 g RY2时,共转移了1 mol电子。则反应的离子方程式是____。
查看答案和解析>>
科目: 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
查看答案和解析>>
科目: 来源: 题型:填空题
氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:
3 SiH4+4NH3 Si3N4+12H2
Si3N4+12H2
(1)以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2(△H < 0)
4NH3↑+SiH4↑+2MgCl2(△H < 0)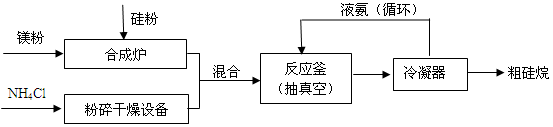
①NH4Cl的化学键类型有____________,SiH4电子式为_______________。
②上述生产硅烷的过程中液氨的作用是________________________。
③氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式_______,实验室可利用如图所示装置完成该反应。 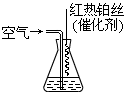
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是_____________。
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_______________________________。将0.184 g三硅酸镁加到50 mL 0.1 mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用0.1 mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8?nH2O的n值为_________。(注:Mg2Si3O8的摩尔质量为260 g/mol)
查看答案和解析>>
科目: 来源: 题型:填空题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: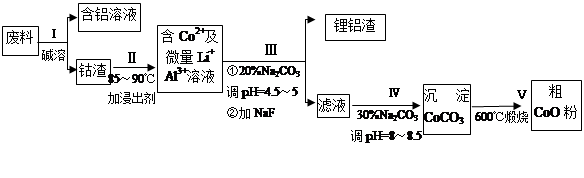
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com