
科目: 来源: 题型:填空题
(10分).
Ⅰ. 下表列出了A~R 9种元素在周期表中的位置(填元素符号):
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
查看答案和解析>>
科目: 来源: 题型:填空题
(11分)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的
形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目: 来源: 题型:填空题
(9分)A、X、Y、Z和W是原子序数依次增大的五种短周期元素。A和X可组成两种常温下为液态的化合物A2X、A2X2,X和Y也可组成两种常温下为固态的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色。在元素周期表中,A与Y同主族,X与Z同主族,Z与W相邻。请同答:
(1)A2X2的结构式 ,Y2X2的电子式 。
(2)X、Z两种元素的氢化物中熔沸点较高的是 (填化学式,下同);工业上将Z的低价氧化物转化为高价氧化物的化学方程式为 。
(3)W元素在周期表中的位置为 ;实验室制备W单质的化学反应方程式为 ;在上述反应中氧化剂和还原剂的物质的量比为 。
查看答案和解析>>
科目: 来源: 题型:填空题
(13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | | | | ① | ② | | ③ | |
| 三 | | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目: 来源: 题型:填空题
(14分)(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点FeO NiO (填“<”或“>”);
②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为 。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ;该晶体中,原子之间的强相互作用是 ;
(3)2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O表示这类特殊晶体的化学式: 。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。
③下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图所示
查看答案和解析>>
科目: 来源: 题型:填空题
(10分)在研究原子核外电子排布与元素周期表的关系时,人们发现外围电子排布相似的元素集中在一起。据此,人们将元素周期表重新分为五个区。在1-36号元素中
(1)在s区中,族序数最大的元素,其原子的价电子的电子云形状为 。
(2)在d区中,人类使用最早,应用最广泛的元素的常见离子的电子排布式为 , 。
(3)在ds区中,原子序数最大的元素,原子的价电子排布式为 。
(4)在p区中,第2周期、ⅤA族元素原子价电子的轨道表示式为 。
查看答案和解析>>
科目: 来源: 题型:填空题
(10分)下表为元素周期表的一部分,所标的字母各代表一种化学元素。
试回答下列问题:
(1)元素M在第________周期第________族。
(2)C的10电子氢化物的电子________,D的简单氢化物的空间结构为________________。
(3)试写出一种由上述3种元素组成的不含有金属元素的离子化台物____________(填化学式)。
(4)上述元素中非金属性最强的元素是_____________(填元素符号),元素最高价氧化物对应水化物酸性最强的物质是_____________(填化学式)。
(5)写出G与I的最高价氧化物对应水化物反应的离子方程式:____________________
查看答案和解析>>
科目: 来源: 题型:填空题
(10分)下图是元素周期表短周期中11种元素的化台价与原子序数的关系示意图,请回答下列问题(用具体的元素符号作答):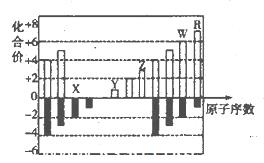
(1)元素x、Y、z、W、R五种元素中属于金属元素的是___________;Z的简单离子的结构示意图是___________。
(2)由此图可以判断,11种元素中处于同主族的共有____________组。
(3)X、Y.Z三种元素的原子半径大小顺序为___________;它们的离子的半径大小顺序为____________。
查看答案和解析>>
科目: 来源: 题型:填空题
(10分)下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下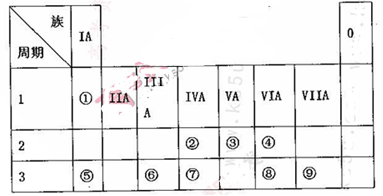
列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图____;写出它与原予半径最小的原子形成10电子且为正四面体结构的化合物的电子式____,用电子式表示⑤和⑧形成化合物的过程________。
(2).④⑤⑧形成的简单离子半径由大到小的顺序为____(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_______(填化学式)。
(3).⑤和⑨形成化合物的化学键为__________。
(4).这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是_______(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式___________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
(12分):【化学——物质结构与性质】
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是 ,电负性最大的是 , 原子半径由小到大的顺序为 。 (填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
(3)A和E可形成离子化合物,其晶胞结构如图所示:则每个晶胞中含阳离子的数目为 ,含阴离子的数目为 ,该离子化合物的化学式为 。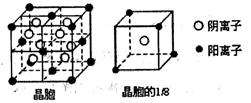
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com