
科目: 来源: 题型:填空题
(14分)Ⅰ(1)过渡金属元素有很多不同于主族元素的性质,如能形成多种配合物,如:Fe(CO)x、[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]、[Cu(NH3)4]SO4等。
①Cu位于元素周期表第四周期第 族。
②配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。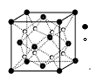
Ⅱ(3)液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
①写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
②下列能说明碳与硫两元素非金属性相对强弱的是 。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
③羰基硫在水存在时会缓慢水解生成H2S,使溶液的pH约为6.5左右,此时钢铁设备会产生的电化学腐蚀主要是 。
查看答案和解析>>
科目: 来源: 题型:填空题
【化学-选修3物质结构与性质】(15分)
请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 .
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 .简述你的判断依据 .
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为 。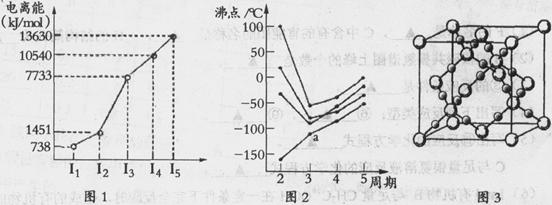
(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为 .
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。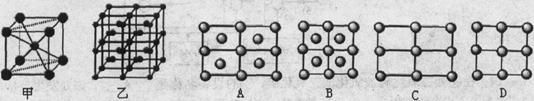 、
、
查看答案和解析>>
科目: 来源: 题型:填空题
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
查看答案和解析>>
科目: 来源: 题型:填空题
某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同

(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)左上图的的堆积方式为 , TK以下经测定其结构和性质参数如下表所示
| 金属 | 相对原子质量 | 分区 | 原子半径/pm | 密度/g·㎝-3 | 原子化热/kJ·mol-1 |
| Na | 22.99 | s区 | 186 | 0.960 | 108.4 |
| A | 60.20 | d区 | r | 7.407 | 7735 |
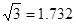 ,7.407≈
,7.407≈ ,1pm=10
,1pm=10 m)
m)查看答案和解析>>
科目: 来源: 题型:填空题
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: | 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目: 来源: 题型:填空题
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。 A和C的氢化物沸点大小关系为 ,原因为
(2)D与E的原子化热分别为340 kJ·mol-1和400kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“="”" )。
(3)分子A2B2中键与键之间的夹角为180°,并有对称性,为非极性分子,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有 键的数目为 。
键的数目为 。
(4)基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
(5)D的氢化物的晶体结构如图所示,其化学式是 。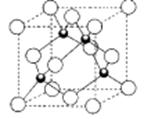
查看答案和解析>>
科目: 来源: 题型:填空题
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。 请完成下列填空:
(1)10Be和9Be 。(填序号)
a.具有相同的化学性质 b.Be 元素的近似相对原子质量是9.5
c.具有相同的中子数 d.通过化学变化可以实现10Be和9Be间的相互转化
(2)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是 。(填序号)
a.比较这两种元素的单质的硬度和熔点
b.将空气中放置已久的这两种元素的单质分别和热水作用
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
(3)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序 (用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干操剂,此化合物的电子式为 。
查看答案和解析>>
科目: 来源: 题型:填空题
(12分) A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式 。
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和氮化镁与水反应的原理相同,写出E3C与盐酸反应的化学方程式 。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式 。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+时,反应中电子转移为4 mol,写出该反应的离子方程式_______________。
查看答案和解析>>
科目: 来源: 题型:填空题
(8分)下列物质中互为同分异构体的有 ,互为同素异形体的有 ,属于同位素的有 ,属于同一种物质的有 。(填序号)
①液氯 ② ③白磷 ④18O ⑤
③白磷 ④18O ⑤
⑥红磷 ⑦16O ⑧氯气
查看答案和解析>>
科目: 来源: 题型:填空题
(14分)X、Y、Z、D、E、W是原子序数依次递增的短周期主族元素。
(1)Y元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,该反应的化学方程式为________________________________;Y与氢原子按个数比1:2形成的含18个电子的化合物的电子式为________________。
(2)X、E同主族,纯净的单质E可用于制太阳能电池,则X在周期表中的位置是________________;X与E作电极,同NaOH溶液可构成原电池,则该电池负极的电极反应式为:______________ 。
(3)常温常压下,W的单质为气体,且常用于自来水的消毒,W的一种氧化物W2O是酸性氧化物,W2O与水反应的方程式为______________ __________________,W2O的结构式为_____________。
(4)Z、D、E、W同周期,D的简单离子半径是同周期简单离子中半径最小的, D的单质与Z的最高价氧化物对应水化物反应的离子方程式为________________________________。
(5)(XY)2与W2性质相似,则(XY)2分子中含有的化学键有_____________________(填“离子键”、“极性键”或“非极性键”);(XY)2的制备原理同实验室制取W2类似,在酸性条件下用MnO2氧化对应的阴离子得到。写出制取(XY)2的离子方程式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com