
科目: 来源: 题型:填空题
(12分)(2012?山东)[化学﹣物质结构与性质]金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是 .
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 .
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .CO与N2结构相似,CO分子内σ键与π键个数之比为 .
(4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 ,甲醇分子内的O﹣C﹣H键角 (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
查看答案和解析>>
科目: 来源: 题型:填空题
(14分) X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与Q分别同主族, X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,W是地壳中含量最多的元素。试回答下列问题:
(1)W、M、Q四种元素的原子半径由大到小的排列顺序是 > > (用元素符号表示)。
(2)元素M和Q可以形成化合物M2Q,写出M2Q的电子式 。
(3) Z、W、Q三种元素的简单气态氢化物中稳定性最强的是 ,沸点最低的是 。(用分子式表示)
(4) W的一种氢化物含18个电子, 该氢化物与QW2化合时生成一种强酸,其化学方程式为 。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为 。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,写出A与足量氢氧化钠溶液在加热条件下反应的离子方程式 。
(7)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+)> > > >c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。解释原因 。
查看答案和解析>>
科目: 来源: 题型:填空题
(14分)现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式),用离子方程式证明 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是 (用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:填空题
(15分)下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语
回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为_______(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_______>_______。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe+氧化,写出该反应的离子方程式_______。
(4)由表中元素形成的物质可发生如图中的反应,
其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式______________.
②写出检验A溶液中溶质的阴离子的方法:______________.
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为_______mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有_______ 。
查看答案和解析>>
科目: 来源: 题型:填空题
(15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
⑴基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ;
⑵E2+离子的价层电子排布图是 ,F原子的电子排布式是 ;
⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 , B元素的气态氢化物的VSEPR模型为 ;
⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ;
⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ;
⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d= g/cm3。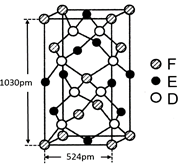
查看答案和解析>>
科目: 来源: 题型:填空题
(12分)【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。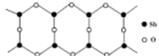
查看答案和解析>>
科目: 来源: 题型:填空题
(12分)【化学——物质结构与性质】
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,无水合硫酸铜可用作杀菌剂等。
(1)Cu2+的核外电子排布式为________________。
(2)科学家通过X射线测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下: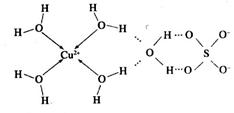
①胆矾的化学式用配合物的形式表示为______。
②胆矾中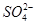 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。
(3)向硫酸铜溶液中加入过量氨水,可生成 配离子。已知
配离子。已知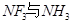 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
(4)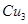 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。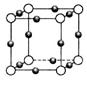
查看答案和解析>>
科目: 来源: 题型:填空题
(12分)【化学——物质结构与性质】
有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同。
(1)A、E形成的化合物E2A2每个分子中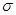 键和
键和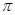 键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________(用实际元素符号表示)。
键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________(用实际元素符号表示)。
(2)BA3易液化的主要原因是__________________。 离子中B原子轨道的杂化类型为__________。
离子中B原子轨道的杂化类型为__________。
(3)写出D元素基态原子的价电子排布式______________。
(4)E的一种单质晶胞结构如图,晶胞的边长为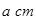 。该晶体的密度为________
。该晶体的密度为________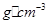 g(NA表示阿伏加德罗常数,E的相对原子质量为b)。
g(NA表示阿伏加德罗常数,E的相对原子质量为b)。
查看答案和解析>>
科目: 来源: 题型:填空题
(16分)X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16。在适当条件下三种单质两两化合,可发生如右图所示变化。己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个。请回答下列问题: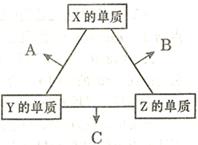
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为 ,相同浓度上述水溶液中由水电离出的c(H+)最小的是 (填写化学式)。
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式 ,溶液中OH-向 极移动(填“正”或“负”)。
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快。
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole- 转移,该反应的化学方程式为 。
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目: 来源: 题型:填空题
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
| 元素 | A | B | C | D | E |
| 相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com