
科目: 来源: 题型:填空题
如图是从元素周期表中截取的一个片断,其中X、Y、Z、W均属于短周期元素。请回答下列问题。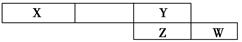
(1)若X单质为空气中的主要成分之一,则W的原子结构示意图为________。
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,这三种酸的正盐的含氧酸根离子中,有两种的电子数相等,这两种离子的离子符号是________、________。
(3)若Na与Y和Z的单质分别反应可以生成摩尔质量相同的两种化合物,其中Na与Y形成的化合物的电子式为________,所含化学键的类型为________。
(4)Y元素在元素周期表中处于第________纵行(写出所有可能纵行数)。
查看答案和解析>>
科目: 来源: 题型:填空题
现有X、Y、Z、M四种元素均为短周期元素。有关信息如下表:
(1)X元素在周期表中第_________周期、第_________族;
(2)Y元素的元素符号为_________,1个单质分子中含_________个共用电子对;
(3)Z能在CO2气体中燃烧,其化学反应方程式为_________ 。
(4)化合物X2M3中,各原子(或离子)最外层均达到8电子稳定结构,则X2M3的电子式为 _________,该化合物的水溶液在空气中久置后会被氧化而变质,生成一种单质,所得溶液呈强碱性。用化学方程式表示这个变化过程_________.
查看答案和解析>>
科目: 来源: 题型:填空题
A、B、C、D、E、F元素是原子序数依次增大的6种短周期元素。已知A是短周期元素中原子半径最小的元素,A和B形成的18电子的化合物X常用作火箭的燃料,C原子最外层电子数与核外电子总数之比为3∶4,E与C同主族,D和C可以形成原子个数比为1∶1和2∶1的两种离子化合物。
据此回答下列问题:
(1)D和C形成1∶1的化合物中阴阳离个数比为____________。
(2)化合物X的结构式为____________。1 mol气态X在适量C2中燃烧,生成B2和气态A2C, 放出534 kJ的热量,1 mol液态A2C完全汽化需吸收44 kJ热量。请写出气态X在C2中燃烧生成B2和液态A2C时的热化学方程式_____________________________________
(3)某化合物由上述6种元素中的3种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为__________________;该化合物水溶液不呈中性的原因是(用离子方程式表示)__________________________________,该化合物可以通过电解D和F形成化合物的水溶液获得,电解时反应的化学方程式为_________________________________
(4)写出一个可以证明C的非金属性大于E的化学反应方程式:_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
下表为部分短周期元素化合价及相应原子半径的数据:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
| 最高化合价 | +6 | +5 | +4 | | +5 | | +7 | +4 |
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
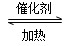 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
查看答案和解析>>
科目: 来源: 题型:填空题
如图所示为血红蛋白和肌红蛋白的活性部分——血红素的结构式。
回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ,写出基态Fe原子的核外电子排布式: 。 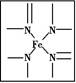
(2)血红素中N原子的杂化方式为 ,在如图的方框内用“→”标出Fe2+的配位键。
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。 
查看答案和解析>>
科目: 来源: 题型:填空题
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液洗后得到无色溶液F,溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素在周期表中的位置是 。
(2)组成单质B的元素的原子结构示意图为 。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯,该反应的氧化剂为 。
(4)溶液F在空气中长期放置生成H的化学方程式为 。
(5)H的溶液与稀硫酸反应产生的现象为 。
查看答案和解析>>
科目: 来源: 题型:填空题
黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S A+N2↑+3CO2↑(已配平)。
A+N2↑+3CO2↑(已配平)。
(1)生成物中除了氮气与二氧化碳外,还有一种物质A,则A的电子式为 ,A属于________化合物。
(2)黑火药中位于元素周期表短周期的元素有 种。其中一种元素的单质可用于制药,其氧化物可用于漂白织物和作防腐剂,该元素在周期表中的位置是 。
(3)黑火药中所含元素的原子半径从大到小的顺序是 (用元素符号表示);
(4)下列事实能说明黑火药中碳与硫两元素非金属性相对强弱的有 。
A.同条件同浓度溶液的pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
查看答案和解析>>
科目: 来源: 题型:填空题
A、B、C、D、E五种短周期元素的原子序数依次增大。元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层电子总数的2倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,元素E与元素B可形成具有正四面体结构的物质。请回答下列问题:
(1)在周期表中,元素B位于第 周期第 族;A与C形成的离子化合物的化学式为 _________________ ; A与C形成的离子化合物与水反应的化学方程式为 。
(2)C形成的简单离子的离子结构示意图为 。
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式: ___________ 。
(4)单质B与水反应是将B充分利用的措施之一,试写出该反应的化学方程式: ______________________________________ 。
查看答案和解析>>
科目: 来源: 题型:填空题
Q、W、X、Y、Z为五种原子序数递增的短周期元素。
已知:①Q原子核外电子数等于电子层数,且与W组成的化合物是沼气的主要成分;
②W与Y、X与Y组成的化合物是机动车排出的大气污染物;
③Y与Z能形成电子总数为30和38的两种离子化合物。
(1)W在周期表的位置:________;电子数为38的Y与Z形成化合物的电子式:________。
(2)工业合成XQ3,ΔH<0;下列措施既能加快反应速率,又能使原料转化率一定都提高的是________。
| A.升高温度 |
| B.加入高效催化剂 |
| C.将XQ3及时分离出去 |
| D.增大反应体系压强 |
查看答案和解析>>
科目: 来源: 题型:填空题
A、B、C、D、E是5种短周期元素,原子序数逐渐增大,A的最简单气态氢化物是一种温室气体,A与C、B与C组成的化合物是机动车排出的大气污染物,C和D能形成原子个数比为1∶1和1∶2的两种化合物,E的最高价氧化物的水化物分别与B、D的最高价氧化物的水化物反应生成盐M和N。试回答下列问题:
(1)A在元素周期表中的位置是___,D2C2中含有的化学键有____________。
(2)工业合成B的气态氢化物BH3是放热反应。下列措施中,既能加快反应速率,又能提高原料转化率的是________(填字母序号)。实验室里检验BH3的方法是_________________。
a.升高温度 b.加入催化剂
c.将BH3及时分离出去 d.增大反应体系的压强
(3)盐M和盐N不能同时存在于水溶液中,用离子方程式表示其原因:__。
(4)A的最高价氧化物与D的最高价氧化物的水化物反应生成的正盐溶液呈________性,其原因是___________________(用离子方程式表示)。
(5)已知:A(s)+C2(g)=AC2(g) ΔH=-393.5 kJ·mol-1
AC(g)+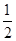 C2(g)=AC2(g) ΔH=-283.0 kJ·mol-1
C2(g)=AC2(g) ΔH=-283.0 kJ·mol-1
则A与C反应生成AC的热化学方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com