
科目: 来源: 题型:填空题
Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: ,其原子核外有 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 (用元素符号表示)。
(2)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,甲的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素可组成多种分子,其空间构型可能是 (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 。
查看答案和解析>>
科目: 来源: 题型:填空题
四种短周期元素A、B、C、D,原子序数依次增大,结合下列信息:
(1)A的最高价氧化物对应的水化物E与其气态氢化物F反应,得到离子化合物G。
(2)B的焰色应呈黄色。
(3)C在同周期主族元素形成的简单离子中,离子半径最小.
(4)D最高正价与最低负价之和为零.
回答下列问题:
(1)写出D在元素周期表中的位置:
(2)写出化合物F的电子式 ,结构式
(3)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是 (填元素符号)
(4)下列可作为比较元素B和C金属性强弱的依据是 ( 填序号)
a.自然界中的含量b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
A的一种氢化物HA3可用于有机合成,其酸性与醋酸相似,体积和浓度均相等的HA3与B的最高价 氧化物对应的水化物的溶液混合,反应的化学方程式是 混合后溶液中离子浓度由大到小的顺序是
查看答案和解析>>
科目: 来源: 题型:填空题
下图是部分短周期元素的常见化合价与原子序数的关系图:
(1)元素A在周期表中的位置 。
(2)用电子式表示D2G的形成过程 ,其所含化学键类型为 。
(3)C2—、D+、G2—离子半径由大到小顺序是 (用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为 , 。
②溶液c中的离子方程式为 。
③请从原子结构的角度解释非金属性B>A的原因 。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为 。
②用一个离子方程式表示该反应 。
查看答案和解析>>
科目: 来源: 题型:填空题
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ,XW的电子式为 ;
(2)Z元素在周期表中的位置是 。
(3)元素U、V、W形成的10电子氢化物中,沸点较低的是 (写化学式);结合H+能力较强的是 (写化学式);用一个离子方程式加以说明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 ,由此可知VW和YW2还原性较强的是 (写化学式)。
查看答案和解析>>
科目: 来源: 题型:填空题
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目: 来源: 题型:填空题
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | 最外层电子数是内层电子数的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目: 来源: 题型:填空题
下图是元素周期表的框架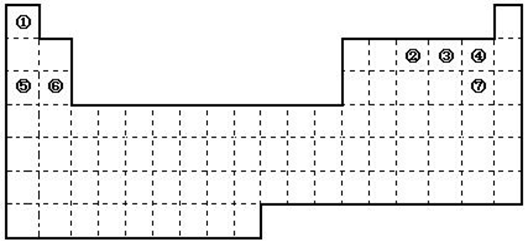
(1)依据元素周期表回答下列问题:
①.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示);
②.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是 (用化学式表示);
③.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写字母a、b、c、d);
a.ⅠA族 b.ⅡA族 c.ⅥA 族 d.ⅦA族
(2)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:填空题
A、B、M、D、E是原子序数依次增大的五种短周期元素。A元素的一种原子中不含中子。B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍。试回答: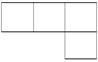
(1)A元素是________ 。
(2)在B、M、D、E四种元素的最简单氢化物中,沸点最高的是__________(填化学式)。
(3)A、B、M、D可组成多种18电子分子,写出 2种具有18电子的有机物的结构简式______、______。
查看答案和解析>>
科目: 来源: 题型:填空题
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是原子半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C和E两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填写编号)
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)C、D两元素形成的原子个数比为1:1的化合物与C、E两元素形成的两种化合物都能反应,且有一种共同的产物,写出这两个反应的化学方程式: ; 。
(3)某工业生产的核心反应是 :2EC2(g) + C2(g)  2EC3(g) △H<0,回答下列问题:
2EC3(g) △H<0,回答下列问题:
①此反应的平衡常数表达式为K= ,随着温度的升高,上述平衡常数
(填“增大”、“减小”或“不变”)。
②将一定量的EC2(g)和C2(g)放入1L密闭容器中,在一定条件下达到平衡,测得EC2为0.11mol,C2为0.05mol,EC3为0.12mol。计算该条件下,反应的平衡常数K= 。EC2的转化为EC3转化率= 。
(4)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(5)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol.液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: 。
②B2A4又称为肼,是一种可燃性液体,肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液,该电池放电时的电极反应式为:正极 ,负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com