
科目: 来源: 题型:问答题
(12分)【化学-物质结构与性质】
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。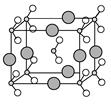
查看答案和解析>>
科目: 来源: 题型:问答题
(13分)[化学——物质结构与性质]由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
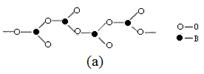
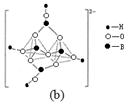
查看答案和解析>>
科目: 来源: 题型:问答题
(15分)
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。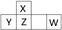
(1) 写出W的原子结构示意图: 。
(2) 将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(3) 已知:①X(s) + O2(g) =XO2(g) ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g) ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g) ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。
(4) ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。写出该电池负极反应式:___________。
(6) 将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。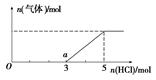
①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)= _______________。
查看答案和解析>>
科目: 来源: 题型:问答题
(13分)有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D | 其氢氧化物和氧化物都有两性,且与C同周期 |
| E | 与C同周期,其原子半径在该周期最小 |
| R | 有多种化合价,其最高正价为+6价 |
查看答案和解析>>
科目: 来源: 题型:问答题
(12分) A、B、C、D、E、F、G七种元素,试按下列所给条件推断,①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气态④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族,C的原子结构示意图是
(2)A元素与D元素形成化合物的电子式是
(3)F的元素符号是
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
查看答案和解析>>
科目: 来源: 题型:问答题
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A—和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。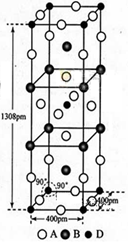
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是 。
查看答案和解析>>
科目: 来源: 题型:问答题
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;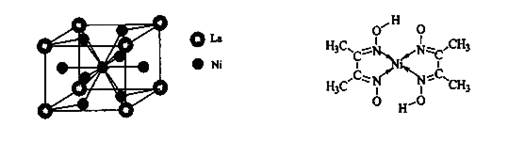
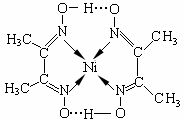
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
查看答案和解析>>
科目: 来源: 题型:问答题
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目: 来源: 题型:问答题
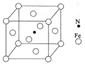
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”而独享2011年诺贝尔化学奖以及奖金。现在,准晶体已在很多应用领域“大展拳脚”,可用来制造不粘锅、发光二极管、热电转化设备等。
(1)铁在周期表中的位置 ,铝的原子结构示意图为 ;
(2)工业炼铝用的原料是 (填Al2O3或AlCl3),不用另一种的原因是
;
(3)铜在潮湿的空气中会生成铜绿,写出该反应方程式
;
(4)用电解法制Fe(OH)2沉淀,下列可做电解质溶液的是
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com