
科目: 来源: 题型:单选题
已知反应:H2S(g)+aO2(g)=X+cH2O(l) ΔH,若ΔH表示该反应的标准燃烧热,则X为 ( )
| A.S(s) | B.SO2(g) | C.SO3(g) | D.SO3(l) |
查看答案和解析>>
科目: 来源: 题型:单选题
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+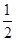 O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+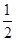 O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
| A.① | B.④ | C.②③④ | D.①②③ |
查看答案和解析>>
科目: 来源: 题型:单选题
火箭推进器中盛有液态肼(N2H4)和液态双氧水,当它们混合时,立即产生氮气和水蒸气,并放出大量的热。已知6.4 g液态肼与足量的液态双氧水反应生成氮气和水蒸气时,放出128.326 kJ的热量。下列热化学方程式正确的是( )
| A.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=128.326 kJ·mol-1 |
| B.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-128.326 kJ·mol-1 |
| C.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1 |
| D.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-256.625 kJ·mol-1 |
查看答案和解析>>
科目: 来源: 题型:单选题
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为( )
| A.-1 780 kJ·mol-1 | B.-1 220 kJ·mol-1 |
| C.-450 kJ·mol-1 | D.+430 kJ·mol-1 |
查看答案和解析>>
科目: 来源: 题型:单选题
已知298 K时,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量 ( )
| A.大于57.3 kJ | B.等于57.3 kJ |
| C.小于57.3 kJ | D.无法确定 |
查看答案和解析>>
科目: 来源: 题型:单选题
下列有关能量转换的说法正确的是( )
| A.煤燃烧是化学能全部转化为热能的过程 |
| B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
查看答案和解析>>
科目: 来源: 题型:单选题
下列热化学方程式或说法正确的是 ( )
| A.甲烷的燃烧热为△H=-890kJ·mol-1,则 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ?mol-1 2NH3(g)△H=-38.6kJ?mol-1 |
| C.已知:H2(g)+F2(g) = 2HF(g)△H=" —270" kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
科目: 来源: 题型:单选题
下列变化过程,属于放热反应的是 ( )
①生石灰与水反应;②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌;③醋酸电离;④固体氢氧化钠溶于水;⑤H2在Cl2中燃烧;⑥浓H2SO4稀释;⑦酸碱中和反应
| A.①②⑤ | B.①⑤⑦ | C.①④⑤⑥⑦ | D.③⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:单选题
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
查看答案和解析>>
科目: 来源: 题型:单选题
已知25℃、101kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s);△H=-2834.9kJ?mol-1
②4Al(s)+2O3(g)=2Al2O3(s);△H=-3119.1kJ?mol-1 由此得出的正确结论是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.反应①可确定铝的燃烧热是708.7KJ |
| C.O3比O2稳定,由O2变O3为放热反应 |
| D.反应②可确定铝的燃烧热是779.78 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com