
科目: 来源: 题型:填空题
(4分,每空1分)如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小片镁片,再用滴管滴5mL稀盐酸于试管中。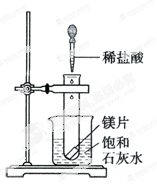
试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述现象的原因是 。
(3)写出有关反应的离子方程式: 。
(4)由实验推知,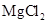 溶液和氢气的总能量 (填“大于”“小于”或“等于”)镁片和稀盐酸的总能量。
溶液和氢气的总能量 (填“大于”“小于”或“等于”)镁片和稀盐酸的总能量。
查看答案和解析>>
科目: 来源: 题型:填空题
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1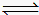 CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。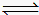 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目: 来源: 题型:填空题
(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
反应②: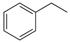 (g)
(g)
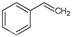 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请
画出t1之后的正逆反应曲线,并作出标注。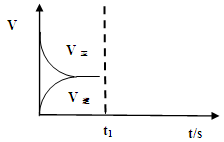
(3)已知某温度下,Ag2SO4饱和溶液中c(Ag+)="0.04" mol/L,则该温度
下Ksp(Ag2SO4)= 。(保留两位有效数字)
(4)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH-=FeO42-+3H2↑,电解质溶液选用NaOH溶液。该电解池阳极材料是 (写化学式);阳极的电极反应式为__ _________。
查看答案和解析>>
科目: 来源: 题型:填空题
(8分)甲醇(CH3OH)被称为21世纪的新型燃料,以煤为原料制备甲醇的流程如下:
(1) 气化炉中主要反应的化学方程式为 。
(2)已知CO、H2、甲醇(l)的燃烧热分别为:—285.8 kJ/mol、—283 kJ/mol、—726.5 kJ/mol;
则CO和H2合成甲醇的热化学方程式为__ __
(3) -定条件下,在催化反应室中发生反应.CO(g)+2H2(g) =CH3OH(g)△H<0;
CO 的平衡转化率与温度、压强的关系如图所示。回答下列问题: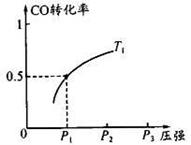
①工业上,上述反应温度不宜过高,原因是_ ___;
②若反应是1 mol CO与2 mol H2在2L容积中进行,则
T1、P1下,该反应的平衡常数为__ __;
维持温度、容积不变,催化反应室再增加l mol CO与2 mol
H2,达到新平衡时,CO的转化率____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:填空题
工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有44g CO2与6g H2恰好完全反应生成气体甲醇和水,放出49.5kJ的热量。试写出该反应的热化学方程式: 。
某次实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
试回答下列问题: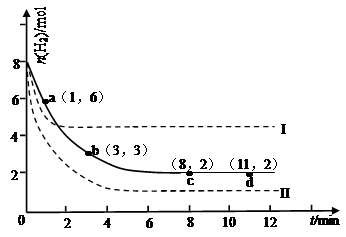
(1)a点正反应速率 (填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是 ,最小的是 。
| A.0~1min |
| B.1~3min |
| C.3~8min |
| D.8~11min |
查看答案和解析>>
科目: 来源: 题型:填空题
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式 。
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(3)已知白磷、红磷燃烧的热化学方程式分别为
P4(s,白磷)+ 5O2=P4O10(s);ΔH=–2986kJ·mol-1
4P(s,红磷)+ 5O2=P4O10(s);ΔH=–2956kJ·mol-1
则白磷比红磷 (填“稳定”或“不稳定”)
(4) 已知一定条件下A2与B2自发反应生成AB3,则反应
A2(g)+3B2(g)=2AB3(g) 的ΔS= 0,ΔH 0 (填“<”、“>”、“=”)
(5)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗 银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 
查看答案和解析>>
科目: 来源: 题型:填空题
降低大气中CO2的含量、减缓温室效十分重要。
(1)工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 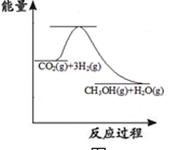
上图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示。则加入催化剂的曲线是 (填:a或b);
0—8min内该反应的平均速率v(CO2)= mol/(L·min)。
(3)在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为a kJ,破坏1molO=O键消耗的能量为bkJ,形成1molC=O键释放的能量为ckJ。则1molCO在空气中完全燃烧生成CO2放出的能量为
kJ。
查看答案和解析>>
科目: 来源: 题型:填空题
(9分)(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。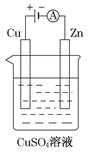
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目: 来源: 题型:单选题
已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是 ( )
| A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2 < Q3 |
| D.若该反应为吸热反应,则Q1+Q2 < Q3 |
查看答案和解析>>
科目: 来源: 题型:单选题
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )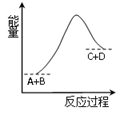
| A.该反应为吸热反应 |
| B.A物质能量一定低于C物质能量 |
| C.该反应只有在加热条件下才能进行 |
| D.反应物的总能量高于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com