
科目: 来源: 题型:填空题
氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请回答下列各题:
用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2+3H2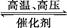 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式 。
(2)如果一个反应的ΔH-TΔS<0,则该反应能够自发进行。已知该反应的ΔS="-198.2" J·K-1·mol-1。则上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。
查看答案和解析>>
科目: 来源: 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 _________________________。
(2)已知H2O(l) H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
___________________________________。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH="+67.7" kJ·mol-1
2NO2(g) ΔH="+67.7" kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
肼和二氧化氮反应的热化学方程式为 __________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g) CO2(g) ΔH1<0①
CO2(g) ΔH1<0①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g) CO(g)+H2(g) ΔH2>0②
CO(g)+H2(g) ΔH2>0②
再燃烧水煤气:
2CO(g)+O2(g) 2CO2(g) ΔH3<0③
2CO2(g) ΔH3<0③
2H2(g)+O2(g) 2H2O(g) ΔH4<0④
2H2O(g) ΔH4<0④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是 。
(3)已知:①C(s)+O2(g) CO2(g) ΔH1="-393.5" kJ·mol-1
CO2(g) ΔH1="-393.5" kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2="-566" kJ·mol-1
2CO2(g) ΔH2="-566" kJ·mol-1
③TiO2(s)+2Cl2(g) TiCl4(s)+O2(g) ΔH3="+141" kJ·mol-1
TiCl4(s)+O2(g) ΔH3="+141" kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)的ΔH= 。
TiCl4(s)+2CO(g)的ΔH= 。
(4)已知下列各组热化学方程式
①Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH1="-25" kJ·mol-1
2Fe(s)+3CO2(g) ΔH1="-25" kJ·mol-1
②3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH2="-47" kJ·mol-1
2Fe3O4(s)+CO2(g) ΔH2="-47" kJ·mol-1
③Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) ΔH3="+640" kJ·mol-1
3FeO(s)+CO2(g) ΔH3="+640" kJ·mol-1
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式 ______________________。
查看答案和解析>>
科目: 来源: 题型:填空题
真空碳热还原—氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s) 3AlCl(g)+3CO(g) ΔH="a" kJ·mol-1
3AlCl(g)+3CO(g) ΔH="a" kJ·mol-1
3AlCl(g) 2Al(l)+AlCl3(g) ΔH="b" kJ·mol-1
2Al(l)+AlCl3(g) ΔH="b" kJ·mol-1
反应Al2O3(s) +3C(s) 2Al(l)+3CO(g)的ΔH= kJ·mol-1(用含a、b的代数式表示)。
2Al(l)+3CO(g)的ΔH= kJ·mol-1(用含a、b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:填空题
工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为 。
查看答案和解析>>
科目: 来源: 题型:填空题
实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为3 916 kJ·mol-1、3 747 kJ·mol-1和3 265 kJ·mol-1,写出这三种物质燃烧时燃烧热的热化学方程式。
(1)环己烷: _______________________。
(2)环己烯: _______________________。
(3)苯: _______________________。
查看答案和解析>>
科目: 来源: 题型:填空题
11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应放出11.46 kJ的热量,该反应的热化学方程式为 ,则KOH与H2SO4的中和热为 。
查看答案和解析>>
科目: 来源: 题型:填空题
已知H+(aq)+OH-(aq) H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出 kJ的热量。
(2)用含2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热为 。
(3)如果将(1)反应中的稀盐酸换成稀醋酸,反应放出的热量 (填“大于”“小于”或“等于”)原来(1)放出的热量。
查看答案和解析>>
科目: 来源: 题型:填空题
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 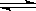 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为
。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)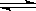 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示: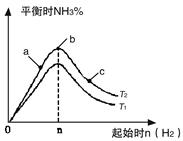
(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是(填字母)。 。
③若容器容积为1L,在起始体系中加入1mol N2 ,n=3mol反应达到平衡时H2的转化率为60%,则此 条件下(T2),反应的平衡常数K= 。保持容器体积不变,再向容器中加入1mol N2,3mol H2反应达到平衡时,氢气的转化率将
(填“增大”、“减”或“不变”)。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol·L—1 | 5.0 | 3.5 | 2.4 |
查看答案和解析>>
科目: 来源: 题型:填空题
把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) = CO2(g)
途径II:先制水煤气: C(s) + H2O(g) =" CO(g)" + H2(g)
燃烧水煤气:2 CO(g) + O2(g) = 2CO2(g);
2H2(g)+O2(g) =2H2O(g)
已知:①C(s)+O2(g)=CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+ 1/2O2 (g) =CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)CO(g) + H2O(g) = H2(g) + CO2(g) 是 (填“放热反应”或“吸热反应”)
(2)根据盖斯定律,煤和气态水生成水煤气的反应热△H= 。
(3)根据两种途径,下列说法错误的是( )
| A.途径II制水煤气时增加能耗,故途径II的做法不可取 |
| B.与途径I相比,途径II可以减少对环境的污染 |
| C.与途径I相比,途径II可以提高煤的燃烧效率 |
| D.将煤转化为水煤气后,便于通过管道进行运输 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com